Casuistik 15
Der Fall
Es stellt sich ein 63 Jahre alter Mann vor, bei dem vor 5 Jahren eine koronare Bypass-Operation durchgeführt worden war. Im Rahmen einer routinemäßigen Kontrolluntersuchung hatte er vor 5 Wochen eine Myokardszintigraphie durchführen lassen und bittet Sie um Ihre Zweit-Meinung, ob der Szintigraphiebefund „gut“ sei.
Was bisher bekannt ist
Bei dem Patienten traten vor 5 Jahren pectanginöse Beschwerden auf. Es wurde eine Herzkatheteruntersuchung durchgeführt, die neben einer hochgradigen Stenose der rechten Koronararterie auch eine „höhergradige“ Stenose des Stamms der linken Koronararterie ergab. Bei der daraufhin durchgeführten Bypass-Operation wurden die linke A. mammaria zum RIVA, die rechte A. mammaria zum R. marginalis 1 und die A. radialis als free graft zum R. marginalis 2 angelegt. Nach der Operation ging es ihm zunächst gut.
17 Monate später kam es allerdings zu wieder zunehmenden Beschwerden. Es wurde erneut eine Herzkatheteruntersuchung durchgeführt, bei der Stents in die rechte Koronararterie implantiert wurden, die Bypass-Gefässe seien funktionsfähig gewesen. Nach diesem Eingriff war der Patient zunächst wieder beschwerdefrei.
Wiederum etwa 1.5 Jahre später kam es zu einem Leistungsknick, der zum Anlaß für eine erneute Herzkatheteruntersuchung genommen wurde. Hierbei fanden sich die beiden Mammaria-Bypass-Gefäße verschlossen, der Radialis-Bypass jedoch offen. Man implantierte mehrere Stents an verschiedenen Stellen der linken Koronararterie, Einzelheiten sind nicht bekannt.
Weil er durch das Operationsergebnis verunsichert war ließ er sich vor etwa 6 Monaten mit Ruhe- und Belastungs-EKG, sowie mittels Myokardszintigraphie untersuchen.
Die Szintigraphie (mit 99mTc-MIBI, Belastung mit ausreichendem Anstieg der Herzfrequenz) zeigte einen summed stress score (SSS) von 8, einen summed rest score (SRS) von ebenfalls 8 und es wurde ein summed difference score (SDS) von 3 berechnet. Die Auswertung erfolgte am 17-Segment-Modell.
In der Auswertung wurde in den Belastungsaufnahmen eine „diffuse Nuklidminderbelegung im Bereich der basalen Anterolateralwand bei ansonsten normaler Radionuklidverteilung im LV-Myokard ohne höhergradige Perfusionsstörungen“ und in der Ruheaufnahme „kein relevanter Unterschied“ beschrieben. Transmurale Narben wurden nicht festgestellt.
Mitgeteilt wurde zudem eine LV-Ejektionsfraktion von 68% unter Belastung und 71% in Ruhe.
Der Patient stellt sich Ihnen mit der Frage vor, wie die SSS, SRS und SDS berechnet werden, was diese Werte aussagen, wie man diese Werte verbessern könnte und ob es sich um ein „gutes“ Ergebnis handelt.
Seit diesem Eingriff ist der Patient anhaltend beschwerdefrei. Er kann intensiv, z.T. mehrere Kilometer täglich mit dem Fahrrad fahren, ohne Probleme zu bemerken. Ruhe- und Belastungs-EKG waren unauffällig, er betreibt intensiv Sport (Fahrradfahren) und seine arteriellen Risikofaktoren sind streng eingestellt.
Antworten
Wie berechnen sich die Scores?
Jede lebende Herzmuskelzelle hat die Fähigkeit, radioaktives „Kontrastmittel“ (= sog. Tracer) aufzunehmen und für eine bestimmte Zeit zu speichern. Ort und Ausmaß dieser Speicherung kann man mit Hilfe von gamma-Kameras aufzeichnen.
In diesen Aufzeichnungen bewertet man die Intensität der Aktivitätsspeicherung in einer 5-stufigen Skala:
- 0 = normale Intensitätsaufnahme
- 1 = gering verminderte Aufnahme
- 2 = mäßig verminderte Aufnahme
- 3 = stark verminderte Aufnahme
- 4 = fehlende Aktivitätsaufnahme.
Diese Bewertung von nehmen die Rechner der Szintigraphiekameras nach einem bestimmten Algorithmus vor.
Um das Ausmaß eines krankhaften Befundes zu beschreiben unterteilt man das Myokard des gesamten linken Ventrikels in 17 Segmente (Abb. 1).
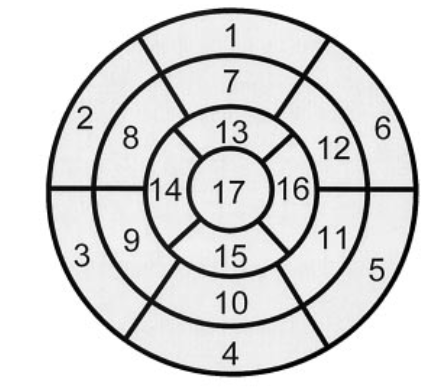
Die Aktivitätsintensität wird für jeder dieser Segmente nach der oben genannten 5-stufigen Skala bestimmt. Die Summe dieser Werte faßt man dann als „summed score“ zusammen.
Diesen summed score bestimmt man zum einen unter körperlicher Belastung (z.B. mit dem Fahrradergometer), wodurch sich der SSS („summed stress score“) ergibt und zum anderen bei einer 2. Untersuchung in Ruhe, woraus sich der SRS ("summed rest score“) ergibt. Der Differenzwert zwischen SSS und SRS bildet dann den SDS („summed difference score“).
Was sagen die Scores aus?
Die Score besagen letztlich nur etwas über die Intensität, mit der sich die gespritzte Aktivität im Herzmuskel anreichert. Ist der Wert 0 reichert sich die Aktivität mit normaler Intensität an, ist der Wert 4 reichert sich keinerlei Aktivität an.
Es gibt 2 Parameter, die die Aktivitätsintensität im lebenden Myokard beeinflussen:
- Die Vitalität des Herzmuskels (d.i. lebt er oder nicht?) und
- die Durchblutung des Herzmuskels, weil von deren Intensität abhängt, welche Menge des Tracers den lebenden Herzmuskel erreicht.
Dabei sind mehrere Szenarien denkbar:
Es besteht ein Unterschied zwischen dem summed score unter Belastung (SSS) und dem Ruhe-Score (SRS).
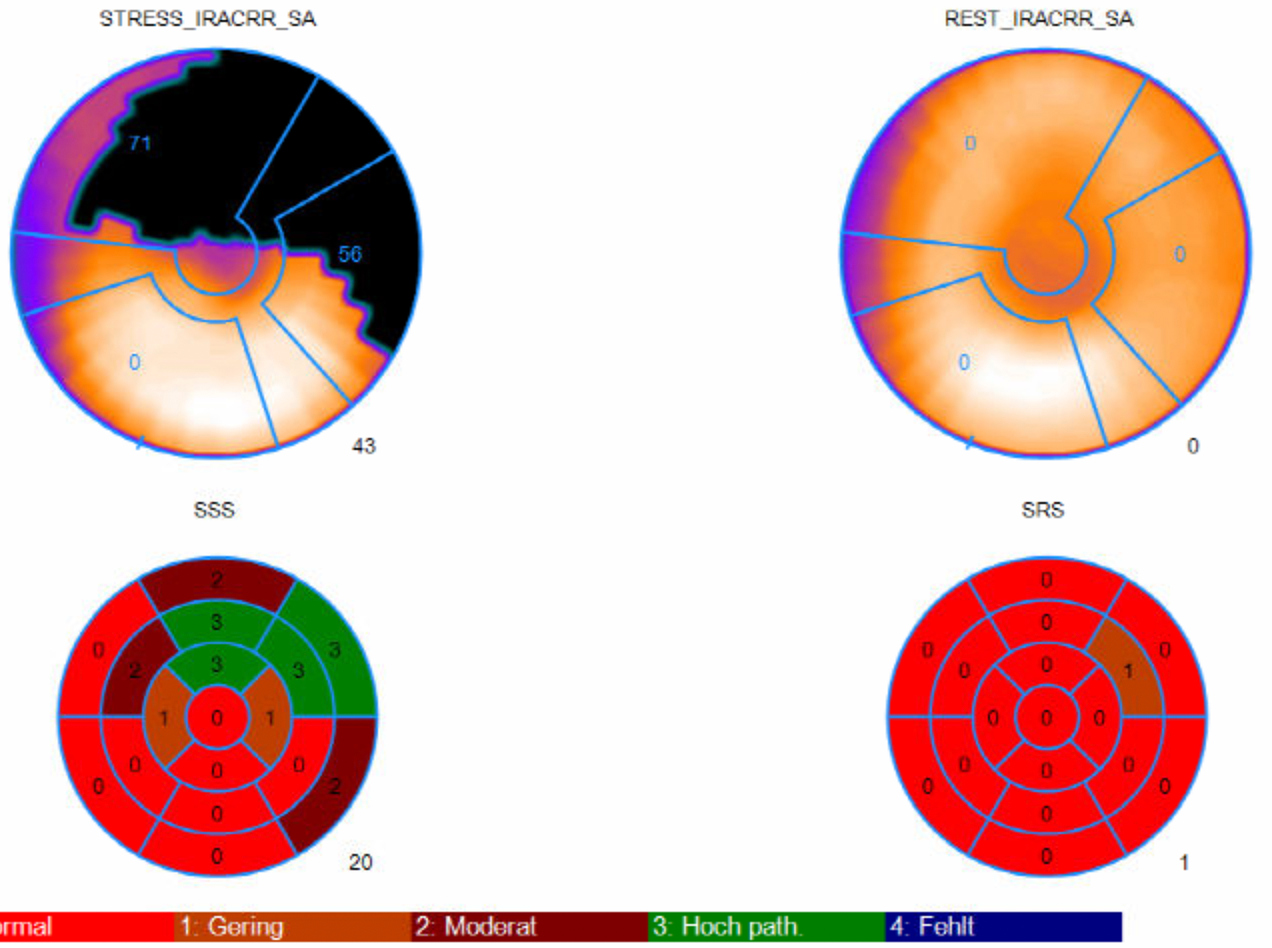
Ist der SSS hoch, der SRS aber normal (z.B. SSS: 20, SRS: 1) (Abb. 2) bedeutet dies, daß sich unter Belastung weniger Aktivität im Herzmuskel anreichert als in Ruhe. Dies ist beispielsweise dann zu beobachten, wenn eine Herzkranzarterie verengt ist:
Unter Belastung führt die Verengung zu einer verminderten Durchblutung des betroffenen Herzmuskelgebietes und damit zu einem hohen SSS. Dieser Befund alleine kann entweder durch eine Durchblutungsstörung des Myokards als auch durch eine Vernarbung bedingt sein. In Ruhe normalisiert sich die Durchblutung und damit die Aktivitätsanreicherung wieder und der SRS sinkt deutlich ab. Dies zeigt an, daß die Aktivitätsverminderung in den Belastungsaufnahmen Ausdruck einer Durchblutungsstörung und nicht einer Vernarbung ist. Bei einer Vernarbung sähe man nämlich einen Befund wie im folgenden Punkt beschrieben.
Es besteht kein Unterschied zwischen SSS und SRS.
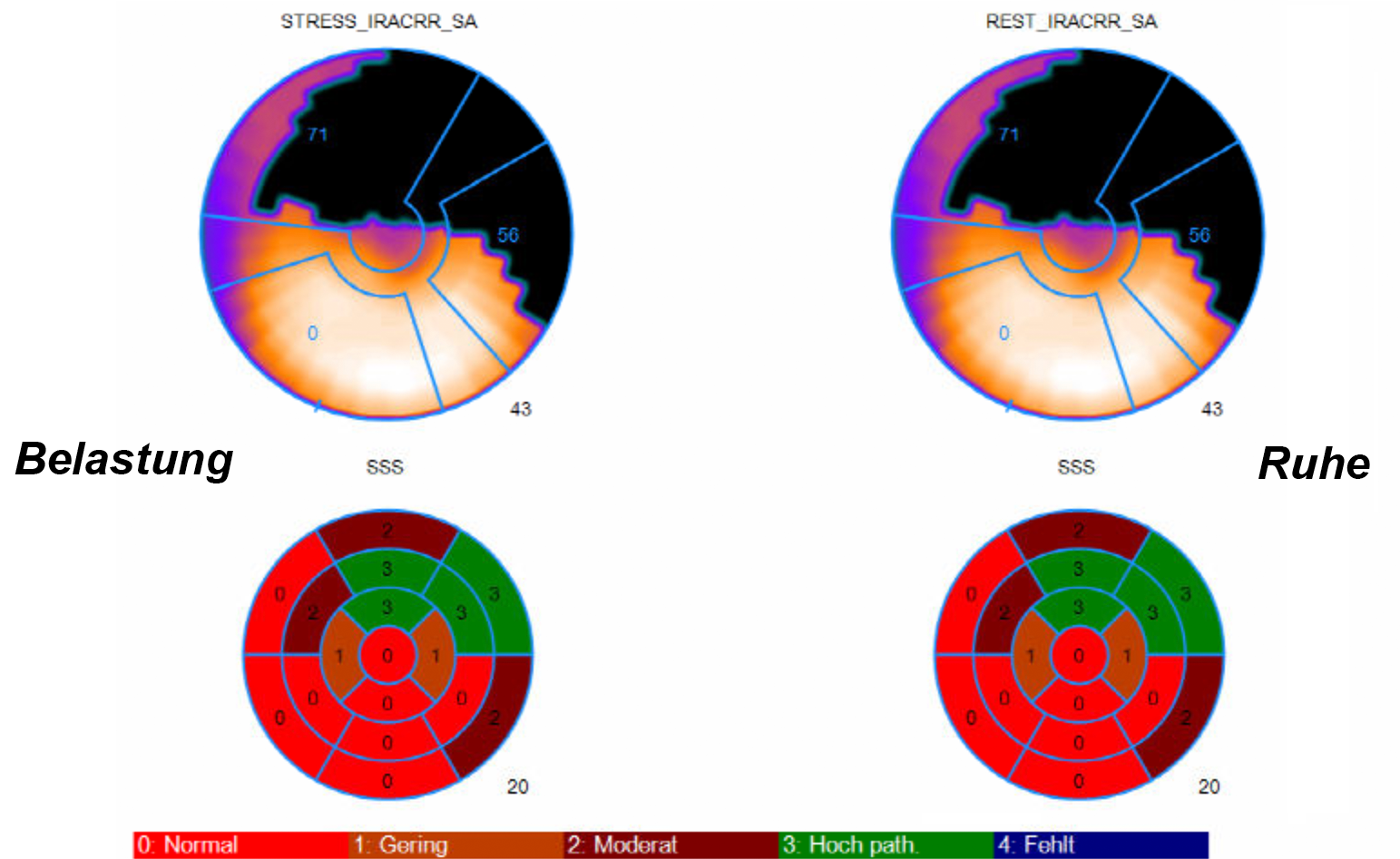
Ist der SSS ebenso hoch wie der SRS (z.B. SSS: 20, SRS: 20) (Abb. 3) zeigt dies an, daß der Herzmuskel in dem auffälligen Bereich vollständig oder teilweise vernarbt ist, die abgestorbenen Herzmuskelzellen nehmen weder unter Belastung noch in Ruhe Aktivität auf.
Die Ausdehnung der Vernarbung kann man dabei nicht aus den Scores heraus lesen, sondern man muß sich vielmehr die einzelnen Szintigraphiebilder ansehen, um zu erkennen, ob etwas die gesamte Vorder- oder Hinterwand oder nur Teile dieser Wände vernarbt sind.
Es besteht ein gewisser Unterschied zwischen dem SSS und dem SRS.
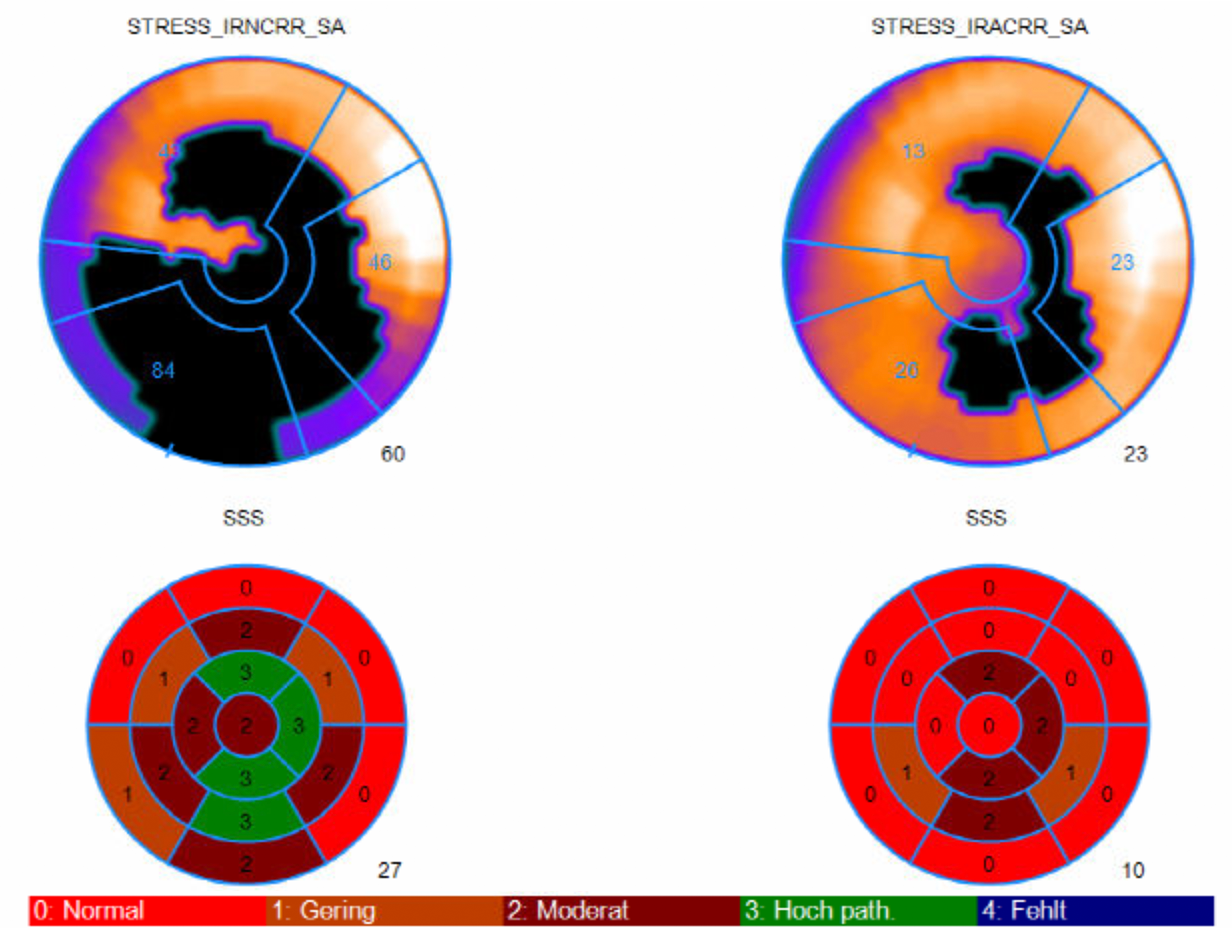
Ist der SSS hoch, der SRS aber deutlich niedriger (z.B. SSS: 20, SRS: 10) (Abb. 4), ohne daß der SRS einen Normalwert anzeigt bedeutet dies, daß der Herzmuskel teilweise abgestorben ist, daß es aber in Ruhe zu einer vermehrten Aktivitätsaufnahme kommt.
Da abgestorbener Herzmuskel keinerlei Aktivität mehr aufnehmen kann folgert man aus einem solchen Befund, in dem betroffenen Bereich noch ein Teil des Herzmuskels überlebt hat, der unter Belastung vermehrt Aktivität aufnehmen kann. Man spricht dann von einer Teilvernarbung mit Durchblutungsstörung (= Ischämie) unter Belastung.
Bei der Betrachtung der Scores macht es einen großen Unterschied, ob die Verminderung der Aktivität nur einen kleinen, umschriebenen oder mehrere Herzmuskelbereiche betrifft.
- Wenn beispielsweise ein Score von 12 gemessen wird und damit eine verminderte Aktivitätsaufnahme angezeigt wird dann kann diese verminderte Aktivitätsaufnahme 3 von insgesamt 17 Herzmuskelsegmente betreffen. Man könnte dann davon ausgehen, daß der Herzmuskel in diesen 3 Segmenten vollständig vernarbt ist (fehlende Aktivitätsaufnahme: Aktivitätsaufnahme-Wert = 4; 12 : 4 = 3 Segmente ohne jedwede Aktivitätsaufnahme = 3 vollständig vernarbte Segmente).
- Wenn sich der Score von 12 allerdings auf 6 Segmente verteilt dann kann dies bedeuten, daß die Aktivitätsverminderung (rein rechnerisch) in 6 Segmenten geringfügig auf einen Einzelwert von 2 pro Segment (12 : 6)) vermindert ist.
Im Fall 1 kann man also (ganz pauschal) von 3 Segmenten ausgehen, die vollständig, d.i. transmural vernarbt sind, während im 2. Fall (wiederum ganz pauschal) 6 Segmente nur teilweise vernarbt sind. Dies sind diejenigen Fälle nicht nicht-transmuralen Narben.
Bei der Beurteilung von Myokardszintigraphien ist es daher von ausschlaggebender Bedeutung, daß man sich ansieht, ob sich ein erhöhter summed score lediglich aus der verminderten Aktivitätsaufnahme in wenigen einzelnen Segmenten ergibt oder ob die Aktivitätsaufnahme in mehreren Segmenten, also mehr diffus vermindert ist.
Kann man die Werte verbessern?
Man selber kann die Werte nicht etwa durch körperliches Training verbessern.
Unter bestimmten Umständen ist eine Verbesserung aber mit bestimmten Behandlungen möglich, bei denen man die Durchblutung des Herzmuskels verbessert. Dies gelingt aber immer nur dann, wenn keine Vernarbungen vorliegen. Beispiele:
Die Szintigraphie zeigt, daß z.B. die Vorderwand des Herzens vollständig vernarbt ist (SSS = SRS, siehe oben).
Weil man abgestorbenen und vernarbten Herzmuskel nicht wieder zum Leben erwecken kann ist eine „Verbesserung“ der Score-Werte nicht zu erwarten, selbst dann nicht, wenn man eine verschlossene Koronararterie, die in das Infarktgebiet führt wieder eröffnen würde.
Dies bezieht sich nicht nur auf vollständig, sondern auch auf nur teilweise vernarbten Herzmuskel, auch dieser ist durch eine Verbesserung oder Normalisierung der Durchblutung nicht wieder zum Leben zu erwecken.
Die Szintigraphie zeigt an, daß der SSS unter Belastung hoch, der SRS aber normal ist.
In diesen Fällen kann man davon ausgehen, daß keine Myokardnarbe vorliegt, sondern daß die betroffenen Muskelsegmente „lediglich“ unter Belastung vermindert durchblutet werden. Ursache hierfür sind in den meisten Fällen Verengungen der Koronararterie. Beseitigt man diese Stenosen durch eine Operation oder eine Ballonerweiterung (mit Stenting) beseitigt man die Durchblutungsstörung. Im Idealfall sollten SSS und SRS dann wieder normale Werte anzeigen.
Eine solche Verbesserung ist natürlich ebenfalls zu erwarten, wenn eine Koronararterie vollkommen verschlossen ist und man sie mit Bypass-Gefäßen oder einer Katheter-Rekanalisation wieder durchgängig macht.
Dasselbe Ergebnis ist zu erwarten, wenn die Szintigraphie zwar ein vernarbtes Myokardareal zeigt, wenn aber zusätzlich noch eine Durchblutungsstörung (z.B. im Umfeld der Narbe) besteht (siehe Abb. 4).
Durch die Rekanalisation einer verschlossenen Arterie bzw. einen Kathetereingriff zur Beseitigung einer Koronarstenose kann man die Durchblutungsstörung des noch lebenden Herzmuskels verbessern, sodaß sich der SRS verbessert, aber (wegen der verbleibenden Narbe, an der man nichts verändern kann) nicht normal werden wird.
Eine Verbesserung der Scores ist also immer nur dann zu erwarten, wenn es szintigraphische Hinweise auf eine Durchblutungsstörung gibt.
Handelt es sich bei unserem Patienten um ein „gutes“ Ergebnis?
Den Begriff „gut“ oder „schlecht“ sollte man im Zusammenhang mit der Beurteilung eines Szintigraphieergebnisses (ebenso wie bei der Beurteilung anderer Untersuchungen) nicht benutzen, denn die Begriffe sind nicht eindeutig definiert:
Bezieht sich „gut“ im Falle unseres Patienten darauf, daß die Bypass-Gefäße offen und durchgängig sind oder auf den Nachweis (oder fehlenden Nachweis) einer Durchblutungsstörung?
Im Falle unseres Patienten mit einem SSS von 12 und einem SRS von ebenfalls 12 zeigt die Szintigraphie eine Vernarbung (oder Teilvernarbung), jedoch keine Durchblutungsstörung an. Ob man dies wegen eines fehlenden Ischämienachweises als „gut“ oder wegen der nachgewiesenen Vernarbung als „schlecht“ ansieht hängt von dem ab, was der Patient unter „gut“ bzw. „schlecht“ versteht. Die Frage ist also zu diffus gestellt, um sie beantworten zu können.
Anmerkungen
Zum Verschluß von koronaren Bypass-Gefäßen
Bei dem hier besprochenen Patienten seien die beiden Mammaria-Bypass-Gefäße verschlossen und der Radialis-Bypass offen. Ursache der Mammaria-Verschlüsse seien, so hat dies der Chirurg erklärt, ausgeprägte Konkurrenzflüsse gewesen. Er meinte damit, daß durch die nativen Koronararterien „mehr Blut fließt als über die Bypässe“.
Der Hintergrund dieser Überlegung besteht in Folgendem:
In Fällen, in denen ein Bypass auf ein nur gering eingeengtes Nativgefäß gelegt wird fließt durch das Nativgefäß selber eine Menge Blut und der Bypass wird eigentlich benötigt. Aus strömungsphysikalischen Gründen gibt es für das Blut keinen Grund, durch einen Bypass zu fließen, denn der Weg über das Nativgefäß ist natürlicher und einfacher. Daher wird der Bypass vermindert durchströmt und diese verminderte Durchströmung kann zu Gerinnselbildungen im Bypass und damit zu seinem Verschluß führen. In diesen Fällen wäre die Anlage eines Bypass-Gefäßes zu einem solchen nur gering veränderten Koronargefäß eigentlich überflüssig gewesen.
Im Fall unseres Patienten kommt hinzu, daß es vielleicht vorstellbar ist, einen solchen „überflüssigen“ (?) Bypass auf 1 Koronararterie zu legen. Aber direkt 2 Bypass-Gefäße auf Gefäße, die nicht bedeutend verengt sind?
Wahrscheinlich hat eine Stammstenose der linken Koronararterie (LCA) vorgelegen, also eine Verengung an dem Gefäßstück zwischen der Aufteilung der LCA in den R. interventricularis anterior (RIVA oder LAD) und dem R. circumflexus (RCx). Und möglicherweise war diese Stammstenose hämodynamisch wenig bedeutsam. Das ändert aber an den oben beschriebenen Überlegung bzgl. eines Konkurrenzflusses zwischen Nativ- und Bypass-Gefäß nichts, auch wenn man für die Operationsbedürftigkeit einer Stammstenose einen anderen Stenosegrad (>50%) anlegt wie für die Operation oder Interventionen an den anderen Gefäßen (>70 - 75%).
Um diese Hypothese zu überprüfen müßte man eigentlich das präoperative Koronarogramm ansehen, um das Ausmaß der die OP-indizierenden Stenosen zu überprüfen. Weil dieser Katheterfilm aber nicht vorlag läßt sich die Frage nach der strömungsphysikalischen Ursache der Bypass-Verschlüsse nicht beantworten.
Aber auch wenn man das genaue Ausmaß der OP-indizierenden Stenose(n) nicht kennt gibt es zu verschlossenen Mammaria-Bypass-Gefäßen 2 weitere Überlegungen:
1. Wurden die Gefäße bei der Koronarographie gut dargestellt?
Es ist in vielen Fällen schwer, die A. mammaria dextra und sinistra mit dem Katheter zu intubieren und mittels Kontrastmittelinjektion darzustellen.
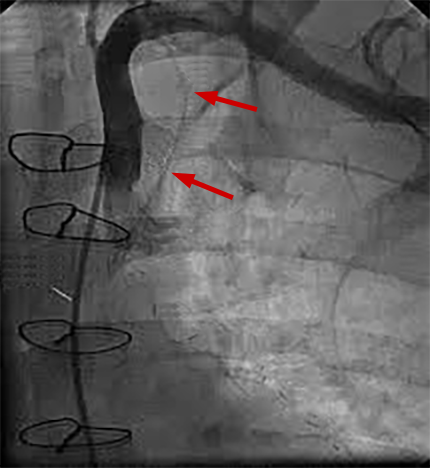
Beide Gefäße entspringen nämlich aus oder aus der Nähe des Scheitelpunktes der A. subclavia. Oftmals verläuft die A. subclavia nicht gerade wie in Abb. 5, sondern gewunden wie in Abb. 6.
 |
 |
| Abb. 5: | Abb. 6: |
| KM-Injektion in die proximale A. subclavia links mit indirekter Darstellung der A. mammaria | KM-Injektion in den Abgang der A. subclavia links. Darstellung der gewunden verlaufenden A. subclavia |
Dies macht es sehr schwer, das Gefäß mit der Spitze des Katheters zu intubieren.
Versucht man in solchen Fällen, das Gefäß indirekt über eine Kontrastmittelinjektion in die A. subclavia darzustellen dann wird man entweder nur eine schemenhafte Darstellung des Gefäßes sehen (und daher vielleicht dessen verdämmernden Verschluß annehmen) oder das Gefäß wird sich überhaupt nicht darstellen, was an seinen Verschluß denken läßt (Film 1).
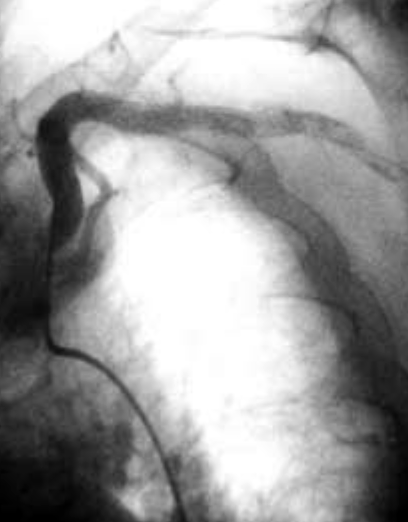
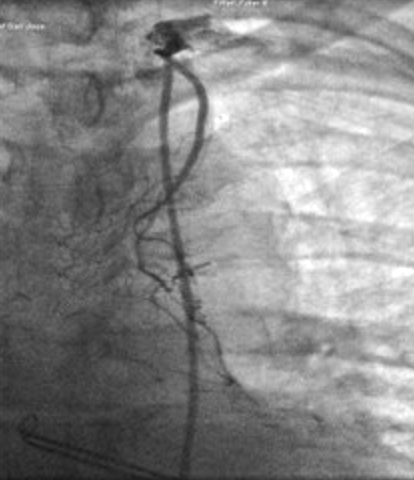
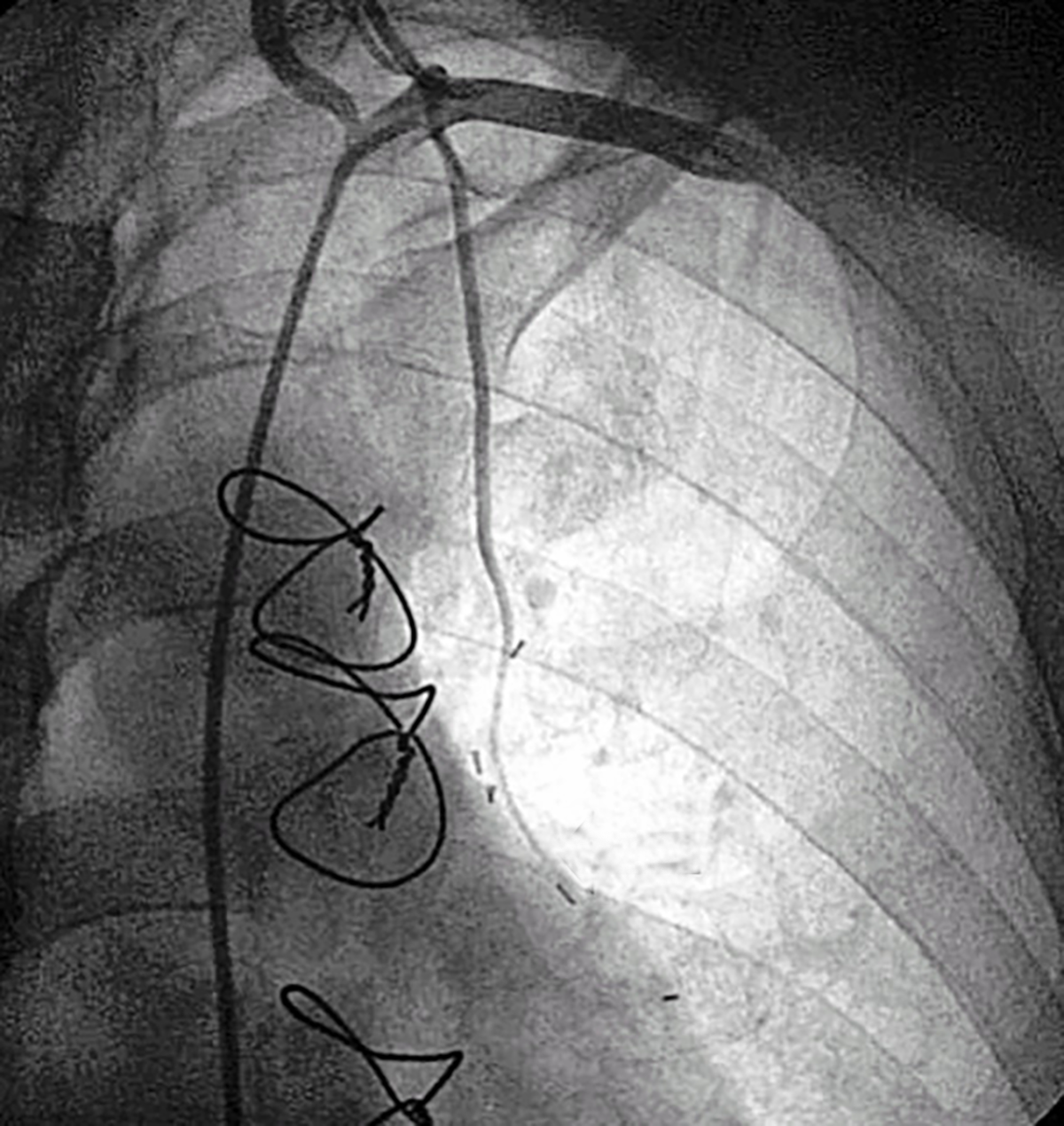
Die Darstellung eines Verschlusses der A. mammaria gelingt in der Regel nur dann, wenn das Gefäß selektiv oder durch eine Abgangs-nahe KM-Injektion kontrastreich dargestellt werden kann (Abb. 7 - 9).
 |
 |
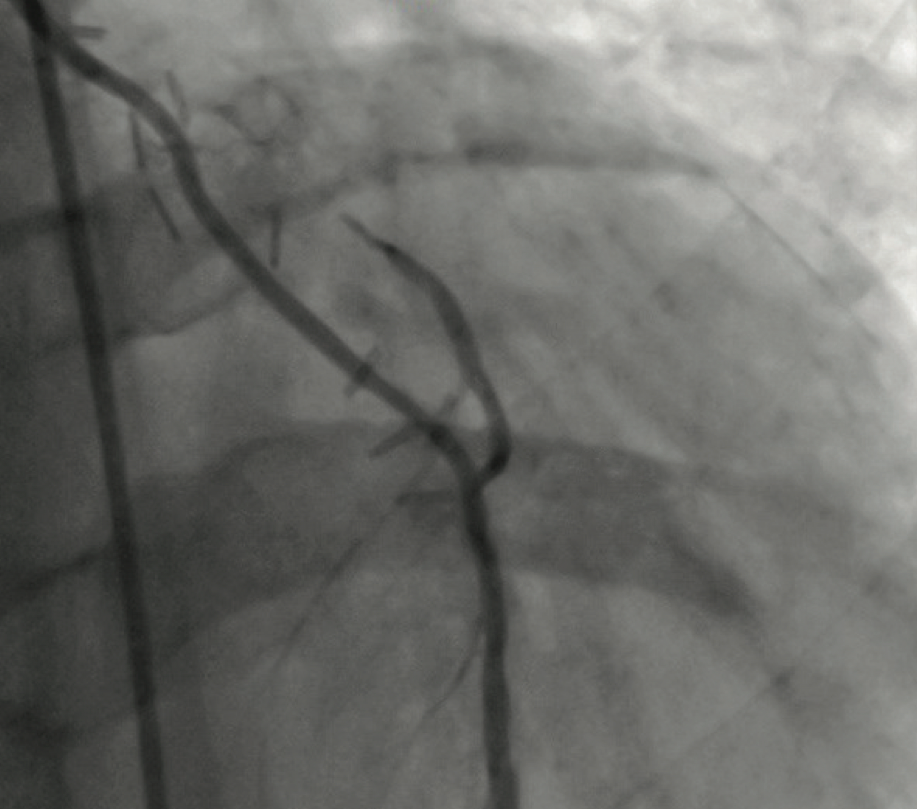 |
| Abb. 7 | Abb. 8 | Abb. 9 |
| Verdämmernder Mammaria-Verschluß vor der peripheren Anastomos | Verdämmernder Mammaria-Verschluß vor der peripheren Anastomose | Verschlossener Mammaria Bypass |
| Es erfolgt kein KM-Übertritt in den RIVA | Es erfolgt kein AM-Übertritt in den RIVA | Retrograde Darstellung des peripheren Bypass bei KM-Injektion in den RIVA |
Für die Diagnose verschlossener Mammaria-Bypass-Gefäße wäre in unserem Fall also notwendig, sich die Bilder der 1. und 2. postoperativen Katheteruntersuchung erneut und kritisch anzusehen.
2. Wenn der Mammaria-Bypass wirklich verschlossen ist
Venöse Bypass-Gefäße verschließen sich in der Regel durch die Proliferation einer Neointima oder durch Probleme an der aortalen bzw. peripheren Naht.
Eine Neointima-Proliferation ist bei Mammaria-Bypass-Gefäßen nicht so häufig. Ursache von Verschlüssen sind hier, neben Problemen an der peripheren Anastomosennaht und einem ausgeprägten konkurrierenden Fluß bei nicht bedeutsam stenosierter Nativarterie Verletzungen der Mammaria bei Ihrer Mobilisierung, um den peripheren Anteil der Mammaria an das Zielgefäß zu führen.
Die A. mammaria interna ist ein sehr zartes, sensibles und empfindliches Gefäß. Auf meine Frage, wieso sich diese Gefäß, von denen man zu Recht annimmt, sie blieben länger als venöse Gefäße offen dennoch verschlössen hat mich ein Kardiochirurg über die Verletzlichkeit der Mammaria aufgeklärt.
Man darf sie nicht so „robust“ behandeln wie ein venöses Bypass-Gefäß, weil man dann Gefahr läuft, daß die sehr empfindliche Intima des Gefäßes verletzt wird und daß es sich verschließt. Meistens geschieht dies im Verlauf des Gefäßes vom Ursprung bis zur peripheren Anastomose (siehe Abb. 7).
Aus der Morphologie des Gefäßverschlüsses (verdämmernd? abrupt?) kann man nicht unbedingt auf seine Ursache schließen. Man kann also nicht sagen, daß ein verdämmernder Verschluß des Gefäßes auf eine zu robuste Operationstechnik zu beziehen ist. Lediglich bei Verschlüssen im Bereich der aortalen oder peripheren Anastomose liegt der Verdacht nahe, daß dies mit der Naht der Anastomose zusammenhängt, „beweisbar“ bzw. pathognomonisch ist dies aber nicht.
Kommentar zur Szintigraphie
Es ist unkollegial und unfair, den Befund eines fremden Kollegen im Nachherein zu kritisieren. Erlauben Sie mir dennoch einige wenige Anmerkungen zu dem hier bei diesem Fall wiedergegebenem Szintigraphiebefundes:
- Bei einem SSS von 12 und einem SRS von ebenfalls 12 ist es rechnerisch nicht möglich, daß ein Differenzscore von 3 beschrieben wird.
Es wird eine Ejektionsfraktion des linken Ventrikels von 68% unter Belastung und von 71% in Ruhe mitgeteilt. Dies kann nicht stimmen, denn:
Die Ejektionsfraktion wird szintigraphisch aus den Bewegungen der linksventrikulären Wände bestimmt, die sich durch die Aufnahme von Aktivität darstellen. Diese Aktivitätsaufnahme des Myokards benötigt jedoch Zeit, weshalb zwischen der Injektion des Radionuklids Technetium und der Anfertigung der Aufnahmen mit der gamma-Kamera etwa 60 - 90 min vergehen müssen. Szintigraphische Aufnahmen können also erst nach dieser Zeit angefertigt werden.
Anders herum bedeutet dies, daß man die Aufnahmen erst 60 - 90 min nach dem Ende der körperlichen Belastung durchführen kann, wenn sich die Aktivität nämlich im Myokard angereichert hat. Zu diesem Zeitpunkt befindet sich das Herz aber längst wieder im Ruhezustand. Unter Verwendung von Technetium ist es also nicht möglich, die Ejektionsfraktion unter Belastung zu messen.
Etwas anderes wäre es, wenn man im Rahmen einer szintigraphischen Herzuntersuchung keine Aktivitätsanreicherung im Myokard mittels MIBI ( Methoxyisobutylisonitril) erreichen will, sondern wenn man Erythrozyten radioaktiv markiert.
Die markierten Erythrozyten verteilen sich im Intravasalraum, also auch in den Cavitäten des Herzens. Nimmt man die Aktivität der Erythrozyten in der Herzgegend mit der gamma-Kamera in ihrem zeitlichen Verlauf auf so erhält man Aktivitätskurven, deren Verlauf durch die Systole und Diastole des Herzzyklus gegeben sind (Abb.10).
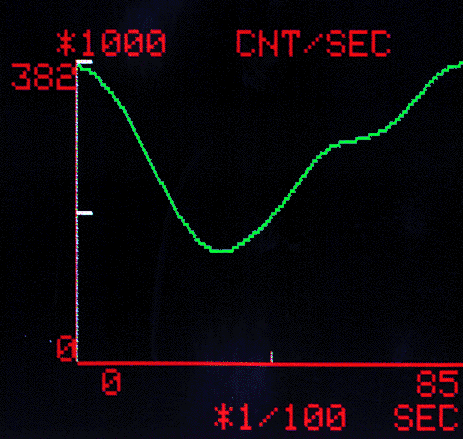
Aus diesen Aktivitätskurven kann man dann das enddiastolische und endsystolische Volumen und damit die Ejektionsfraktion des linken Ventrikels bestimmen.
Das Verfahren wird gated blood pool-Untersuchung genannt, wird aber in der kardiologischen Routinediagnostik (wie auch in unserem Fall) heute kaum noch eingesetzt. Daher ist es bei Verwendung des „üblichen“ Nuklids (MIBI) nicht möglich, die Ejektionsfraktion des linken Ventrikels unter Belastung zu ermitteln.
Die zusammenfassende Beurteilung des Szintigraphie-Ergebnisses ist mißverständlich formuliert:
Es wird eine „diffuse Nuklidminderbelegung im Bereich der basalen Anterolateralwand“ beschrieben, was im Einklang mit den auf 12 erhöhten Scores steht, wobei „keine transmurale Narben festgestellt“ wurden.
Gleichzeitig wird ein „positiver Vitalitätsnachweis im gesamten LV-Myokard“ beschrieben, wobei allerdings auch erwähnt wird, daß es keine Hinweise für eine transmurale Infarktnarbe gebe.
Nachdem eine transmurale Narbe ausgeschlossen werden konnte muß man davon ausgehen, daß die auf 12 erhöhten Scores und die diffuse Aktivitätsanreicherung Ausdruck einer Teilvernarbung der basalen Anterolateralwand sind.
Natürlich ist eine teilweise, d.h. nicht transmurale Vernarbung ein weniger gravierender Befund als der Nachweis einer transmuralen Vernarbung. Dennoch bin ich der Meinung, daß die Erwähnung auch einer nicht transmuralen Vernarbung zur Beschreibung eines vollständigen myokardszintigraphischen Befundes dazu gehört.
Wie sollte man Kontrolluntersuchungen nach Bypass-Operation oder Koronarstenting durchführen?
Im Vordergrund solcher Kontrolluntersuchungen steht die Antwort auf die Frage nach den arteriellen Risikofaktoren. Diese sollten im Rahmen der Sekundärprävention streng eingestellt werden, um ein Fortschreiten der Koronarerkrankung, eine Stenoserezidiv nach Stenting bzw. Bypass-Verschlüsse nach Möglichkeit zu verhindern. So befremdlich dies vor allem für die Betroffenen sein mag: Die Frage nach der Durchgängigkeit von Bypass-Gefäßen oder evtl. Redizivstenosen steht erst an 2. Stelle.
Im Rahmen von Kontrolluntersuchungen gehören
- Anamnese (Beschwerden? Dyspnoe? Belastbarkeit),
- körperliche Untersuchung (RR, Größe, Gewicht, arterieller Pulsstatus, Auskultationsbefund des Herzens) und
- ein Ruhe-EKG (Herzfrequenz? Rhythmus? ST-T-Veränderungen? Veränderungen zum präoperativen bzw. präinterventionellen Befund (!!)?)
zum Basis-Programm.
Im Rahmen der Risikostratifizierung werden labortechnisch der Lipidstatus (Cholesterin, LDL), Kreatinin und ein kleines Blutbild durchgeführt.
Diese Basisuntersuchungen werden im 1. Jahr nach dem Eingriff alle 6 Monate, danach 1mal jährlich empfohlen.
Bei Patienten, bei denen präoperativ bzw. präinterventionell eine regionale LV-Kontraktionsstörung festgestellt worden war kann man im Verlauf der ersten beiden Untersuchungen im 1. postoperativen bzw. -interventionellen Jahr auch eine erneute Echokardiographie durchführen und diese mit dem präoperativen bzw. präinterventionellen Befund vergleichen, um zu sehen, ob der Eingriff zu einer Verbesserung der Kontraktionsstörung geführt hat.
Bei Patienten mit bekannter global eingeschränkter LV-Pumpfunktion empfehlen sich Echountersuchungen immer einmal jährlich, jedoch besteht die Indikation hierfür im Rahmen von Verlaufsuntersuchungen bei Herzinsuffizienz.
Weitere Untersuchungen, die die Frage nach der anhaltenden Durchgängigkeit von Bypass-Gefäßen bzw. dem Zustand dilatierter oder mittels Stenting behandelter Koronararterien dienen wären ein Belastungs-EKG, Stress-Echo, Myokardszintigraphie, Kardio-CT, Kardio-MRT oder sogar eine Koronarographie.
Immer dann, wenn ein Patient symptomatisch ist, vor allem, wenn sich an seiner Symptomatik etwas verändert oder wenn beispielsweise Veränderungen des Ruhe-EKG festgestellt werden sind solche weiterführenden Untersuchungen sinnvoll und notwendig. Dabei muß dann sehr individuell über die Art der weiterführenden Diagnostik entschieden werden.
Von einem routinemäßigen Einsatz solcher Untersuchungen kann nur abgeraten werden, denn man muß berücksichtigen, daß alle diese Untersuchung falsch positive Ergebnisse haben können, die dann zu einer Eskalation der Diagnostik führen können. Wenn z.B. ein beschwerdefreier und gut belastbarer Patient ein Kardio-CT durchführen ließe und wenn sich dabei mögliche Bypass-Verschlüsse oder -Stenosen zeigen würden dann könnte in letzter Konsequenz eine Herzkatheteruntersuchung stehen. Aber was macht man, wenn sich ein Bypass-Verschluß hierbei bestätigen würde? Noch einmal operieren? Dilatieren oder einen Stent implantieren? Ein Stress-Echo, eine Myokardszintigraphie oder ein Kardio-MRT durchführen, um nach Ischämien zu suchen?
Wenn es um die Frage einer weiterführend Diagnostik geht sollte also bereits in deren Vorfeld (vor allem anhand der klinischen Symptomatik) entschieden werden, ob evtl. eine Re-OP oder erneute Katheterintervention indiziert sind. Wenn dies wenig wahrscheinlich ist sollte man auch keine weiterführende Diagnostik durchführen.
Das praktische Problem besteht bei Bypass-operierten Patienten allerdings bei der Beurteilung der Beschwerden. Diese Patienten sind nämlich möglicherweise durch eine OP-bedingte sensorische Denervation des Herzens oftmals trotz verschlossener oder verengter Koronargefäße oligo- bis asymptomatisch.
Auch hier würde man allerdings routinemäßig und ohne gegebene Indikation ebenfalls keine Untersuchungen i.S. von Stress-Echo, Myokardszintigraphie, Kardio-CT, Kardio-MRT oder gar Koronarographie durchführen. Es wäre vielleicht allenfalls sinnvoll, mit Hilfe eines Belastungs-EKG nach möglichen Ischämien zu suchen (was bei niedriger Sensitivität und Spezifität dieser Untersuchung aber nicht gut gelingt), vor allem aber die körperliche Belastbarkeit des Patienten zu untersuchen, um dann bei deren Einschränkung über das weitere diagnostische Vorgehen zu entscheiden. Auch hier gilt allerdings: Ohne sinnvolle therapeutische Konsequenzen keine weiterführenden Untersuchungen.
Was würden Sie dem Patienten bei den bekannten Befunden raten, was soll er jetzt machen?
Im Grund genommen ist das Behandlungsergebnis, soweit es sich aus den mitgeteilten Befunden ergibt, als gut zu bezeichnen: Seine arteriellen Risikofaktoren sind gut eingestellt, er ist beschwerdefrei, kann sich intensiv körperlich belasten und es gibt szintigraphisch keinen Ischämienachweis.
Ich würde ihm raten, sich auch weiterhin völlig normal und ohne Einschränkungen zu verhalten, seine sportliche Tätigkeit (Fahrrad fahren) beizubehalten, seine arteriellen Risikofaktoren unverändert zu behandeln, sich beim Hausarzt zur Überprüfung der Risikofaktoren alle 6 Monate und sich beim Kardiologen etwa einmal jährlich vorzustellen.
Der Hinweis darauf, daß er unverzüglich zum Hausarzt oder Kardiologen gehen sollte, wenn sich an seinem Beschwerdebild bzw. seiner körperlichen Leistungsfähigkeit etwas ändern sollte ist natürlich selbstverständlich.