Einleitung
Die Aorta ist das zentrale Blutgefäß des menschlichen Körpers. Ca. 200.000.000 l fließen während des Lebens hindurch. Anatomisch unterteilt man das Gefäß „Aorta“ in die thorakale und die abdominale Aorta, wobei die Grenze zwischen beiden Abschnitten das Zwerchfell ist.
Die thorakale Aorta wiederum gliedert man in Aortenwurzel, aszendierende Aorta, Aortenbogen und deszendierende Aorta, die abdominale Aorta wird in die supra- und infrarenale Aorta aufgeteilt.
Die Aorta kann durch verschiedene angeborene und erworbene Erkrankung betroffen sein. Diese Erkrankungen können die thorakale und/oder abdominale Aorta betreffen, sie können akut oder chronisch sein.
Die akuten Aortensyndrome
Die verschiedenen akuten Aortensyndrome sind lebensbedrohliche Erkrankungen. Hierzu gehören die klassische akute Aortendissektion (AAD), das intramurale Hämatom (IMH), das penetrierende arteriosklerotische Aortenulcus (PAU) incl. der Ruptur der thorakalen Aorta.
Alle diese Erkrankungen basieren pathophysiologisch auf der Schwächung von Intima und Media, haben eine ähnliche klinische Symptomatik und stellen die Ärzte vor erhebliche diagnostische und therapeutische Herausforderungen.
Klassische akute Aortendissektion
Die klassische Aortendissektion (85 - 95% aller Fälle mit akutem Aortensyndrom) ist durch einen intimalen Einriß gekennzeichnet, durch den sich Blut in die Aortenwand einwühlt und hier zu einem falschen Lumen führt. Es ist schwer, die wahre Inzidenz der klassischen Aortendissektion zu bestimmen, weil aufgrund der hohen prähospitalen Sterblichkeit eine Vielzahl von Patienten übersehen wird, solange keine Sektion durchgeführt wird. Man schätzt aber, daß sie jährlich in etwa 2.5 - 3.5 / 100.000 Menschen auftritt. Bei Sektionen zählt man 0.2 - 0.8% aller Fälle. Erstaunlicherweise gibt es Untersuchungen darüber, daß die Inzidenz der akuten Aortendissektion im Dezember, an Montagen und vormittags zwischen 6 - 12:00 h am höchsten ist. Erklären kann man dies nicht.
Klassifikation
Es gibt 2 Klassifikationen einer Aortendissektion: Diejenige nach DeBakey, die den Eintrittsort des Dissektionseinrisses und ihre Ausdehnung beschreibt und die Stanford-Klassifikation, die sich danach richtet, ob die aszendierende Aorta betroffen ist (Typ A) oder nicht (Typ B). Der Ursprungsort des Dissektionseinrisses spielt bei der Stanford-Klassifikation keine Rolle.
Klassifikation nach DeBAKEY
(Abb. 1)
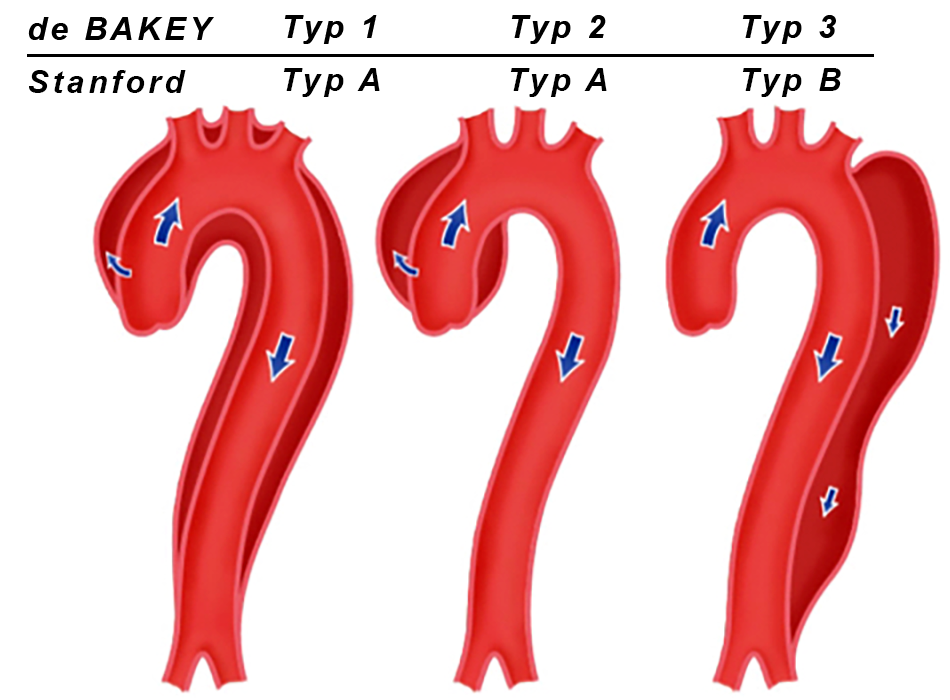
Typ 1 Einriß der Dissektion in der aszendierenden Aorta; Ausbreitung der Dissektion weiter nach distal und Erfassung mindestens des Aortenbogens, typischerweise auch die deszendierende Aorta Typ 2 Einriß der Dissektion ausschließlich in der aszendierenden Aorta Typ 3 Einriß der Dissektion in der Aorta deszendens, Ausdehnung oft weiter nach distal Typ 3a Einriß nur in der deszendierenden thorakalen Aorta Typ 3b Einriß über das Zwerchfell hinausgehend
Klassifikation nach Stanford
(siehe Abb. 1)
Typ A Alle Dissektionen, die unabhängig vom Einrißort die aszendierende Aorta betreffen Typ B Alle Dissektionen, die nicht die aszendierende Aorta betreffen (Wenn ausschließlich der Aortenbogen ohne die Aorta aszendens betroffen ist handelt es sich um eine Stanford-Dissektion Typ B)
Klassifikation nach Svensson
(Abb. 2)
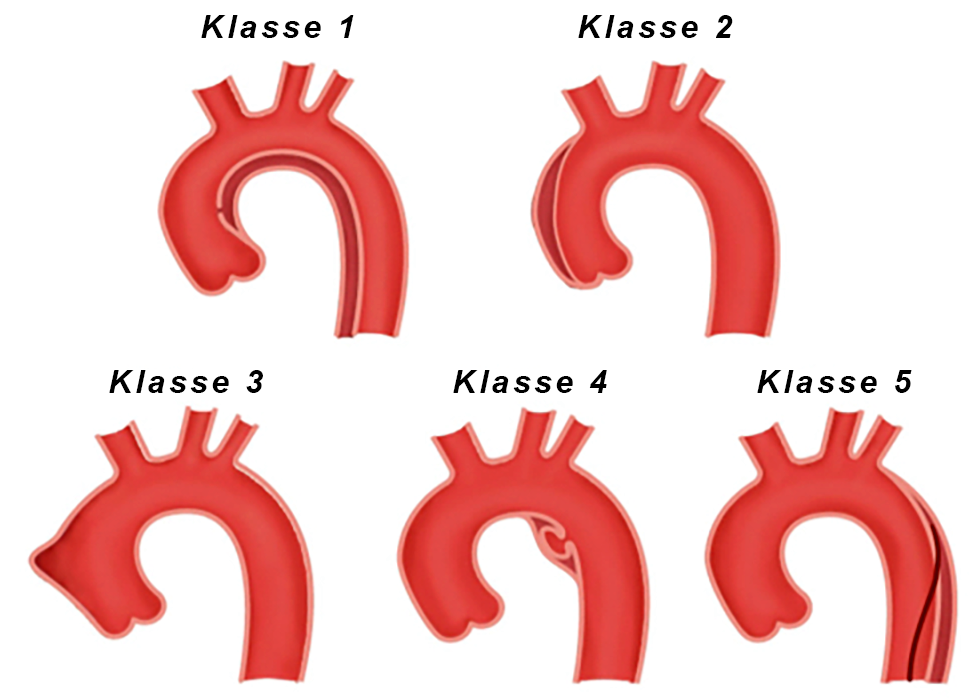
| Klasse 1 | Klassische Dissektion mit wahrem und falschem Lumen |
|---|---|
| Klasse 2 | Intramurales Hämatom oder intramurale Blutung |
| Klasse 3 | Kleine Dissektion ohne Hämatom |
| Klasse 4 | Penetrierende arteriosklerotisches Aortenulcus |
| Klasse 5 | Iatrogene oder traumatische Dissektion |
Gemäß der Europäischen Gesellschaft für Kardiologie teilt man das akute Aortensyndrom in 3 Gruppen ein:
Akut: Dauer <14
Subakut: Dauer 15 - 90
Chronisch: Dauer >90 d
Eine andere Einteilung berücksichtigt die Überlebenskurven in Abhängigkeit von der gewählten Therapie (Operation, Stenting, medikamentöse Therapie:
Hyperakut: Dauer <24 h
Akut: Dauer 2 - 7 d
Subakut: Dauer 8 - 30 d
Chronisch: Dauer >30 d
Risikofaktoren
Risikofaktoren für die Entstehung einer thorakalen Aortendissektion sind eine erhöhte mechanische Wandbelastung (durch arterielle Hypertonie oder Trauma) und/oder Veränderungen der Media der Aorta (genetische Erkrankungen, Tab. 1):
| Verstärkte aortale Wandbelastung | Arterielle Hypertonie (gut oder nicht ausreichend eingestellt) |
|---|---|
| Phäochromozytom | |
| Gebrauch von Kokain oder anderen Stimulantien | |
| Gewichtheben oder andere Zusammenhänge mit VALSALVA-Manöver | |
| Trauma (z.B. Deceleration bei Autounfall, Sturz vom Pferd, Pferdetritt, Sturz) | |
| Aortenisthmusstenose | |
| Veränderungen der aortalen Media: | Genetisch |
| MARFAN-Syndrom | |
| Vaskuläre Form des EHLERS-DANLOS-Syndroms | |
| Bicuspid angelegte Aortenklappe (einschließlich der zuvor operierten Fälle) | |
| TURNER-Syndrom | |
| LEOYS-DIEZ-Syndrom | |
| Familiär gehäuftes Auftreten von Aortenaneurysma oder Aortendissektion andere genetische Veränderungen (z.B. Fibrillin, Tumor-Wachstumsfaktor-beta-Rezeptor (SMAD3)) | |
| Entzündliche Vaskulitis | TAKAYASU-Krankheit |
| Riesenzellen-Arteriitis | |
| BEHÇET-Arteriitis | |
| Andere | Arteriosklerose |
| Schwangerschaft | |
| Polycystische Nierenerkrankung | |
| Chronische Gabe von Steroiden oder Immunsuppressiva | |
| Infektion der Aortenwand z.B. im Rahmen einer Bakteriämie oder von benachbarter Struktur fortgeleitet |
Die meisten Patienten (77%) haben eine arterielle Hypertonie in der Vorgeschichte, wobei dies etwas mehr den Typ B als den Typ A betrifft (81% resp. 74%%). Die arterielle Hypertonie als Risikofaktor betrifft allerdings weniger junge Menschen (<40 J) als ältere.
Risikofaktoren bei Patienten <40J haben häufiger ein MARFAN-Syndrom, eine bicuspid angelegte Aortenklappe, frühere Eingriffe an der Aorta und größere Aortendurchmesser.
In beiden Altersklassen, d.i. den jüngeren wie den älteren ist das Mortalitätsrisiko aber ähnlich.
Es gibt auch ethnische Unterschiede: Dunkelhäutige Menschen sind im Vergleich zu Weißen jünger und sind etwas häufiger vom Typ B der Aortendissektion betroffen. Darüber hinaus sind arterielle Hypertonie und Kokain-Gebrauch bei dunkelhäutigen Menschen häufiger Ursache für Aortendissektionen als bei Weißen. Krankenhaus-Sterblichkeit und Langzeit-Überleben sind bei beiden ethnischen Gruppen aber ähnlich. Ärzte sollten immer daran denken, daß frühere Eingriffe an der Aorta oder nach herzchirurgischen Eingriffen Risikofaktoren für das Auftreten von Aortendissektionen sind.
Das Risiko einer Aortendissektion im Zusammenhang mit Herzkatheteruntersuchung ist sehr gering (ca. 0.06%), wobei diese Dissektionen auch bei konservativer, nicht chirurgischer Behandlung eine gute Kurz- und Langzeitprognose haben.
Im Zusammenhang mit schweren Decelerationstraumata (z.B. bei Autounfällen) muß man stets daran denken, daß akute Aortendissektionen auftreten können. Solche Dissektionen haben eine mit 15 - 20% hohe Sterblichkeit. 95% aller Dissektionen treten dabei im Bereich des Aortenisthmus und 5% in der aszendierenden Aorta auf. Sie sind häufig mit Herzversagen, Myokardinfarkt oder Perikardtamponade verbunden.
Klinik
In der Regel stellen sich die Patienten mit typischen, plötzlich einsetzenden heftigen Brustschmerzen vor. Die Beschwerden können aber durchaus auch unspezifisch sein, immerhin beklagen aber etwa 5% aller Patienten keinerlei Beschwerden (Tab. 2).
| Häufigkeit gesamt (%) | Häufigkeit Typ A (%) | Häufigkeit Typ B (%) | |
|---|---|---|---|
| Vernichtungsschmerz | 88 | 87 | 89 |
| Plötzlicher Schmerzbeginn | 84 | 83 | 85 |
| "Wandernder" Schmerz | 15 | 14 | 17 |
| Schmerz innerhalb von 6 h nach Beschwerdebeginn | 14 | 17 | 7 |
| Fokales neurologisches Defizit | 88 | 87 | 89 |
| Brust- oder Rückenschmerzen | 88 | 87 | 89 |
| Arterielle Hypotonie, Schock, Tamponade | 23 | 33 | 5 |
| Arterielle Hypertonie bei Vorstellung | 40 | 28 | 65 |
| Pulsdefizit | 32 | 36 | 26 |
| Aortenklappeninsuffizienz | 39 | 52 | 14 |
| Bauchschmnerzen | 30 | 25 | 41 |
| Vernichtungsschmerz | 88 | 87 | 89 |
Die meisten Patienten mit akuten Aortensyndrom sind Männer (ca. ⅔) in der 7. Lebensdekade (32% >70 J, 7% <40 J) mit arterieller Hypertonie in der Vorgeschichte. Frauen sind in etwa 32% der Fälle betroffen. Wenn sie jedoch erkrankt sind sind sie im Mittel 6 - 7 Jahre älter als Männer (50% ≥70 J). Dies läßt sich vielleicht dadurch erklären, daß Frauen seltener „typische“ Beschwerden angeben, daß der Schmerz weniger stark empfunden wird und daß bei Frauen öfter Bewußtseinsstörungen auftreten als bei Männern.
Frauen haben eine höhere Krankenhaussterblichkeit als Männer, was hauptsächlich daran liegt, daß die Sterblichkeit operierter Frauen mit Typ A-Dissektion höher ist als bei Männern (32% bzw. 22%).
Untersuchungsbefunde
EKG, Röntgen-Thorax, Labor
Weder EKG noch Röntgen-Thoraxbild sind beweisend und in vielen Fällen zudem nicht wegweisend.
Im 12-Kanal-EKG sieht man am häufigsten unspezifische Veränderungen oder die Zeichen der myokardialen Ischämie, es ist aber bei etwa ⅓ aller Patienten vollkommen normal.
| Häufigkeit gesamt (%) | Häufigkeit Typ A (%) | Häufigkeit Typ B (%) | |
|---|---|---|---|
| Unauffällig | 39 | 38 | 41 |
| LV-Hypertrophie | 23 | 21 | 27 |
| Myokardiale Ischämie oder Infarkt | 18 | 22 | 10 |
Im Röntgen-Thorax sieht man eine Verbreiterung des Mediastinums allenfalls in der Hälfte aller Fälle (Tab. 4).
| Häufigkeit gesamt (%) | Häufigkeit Typ A (%) | Häufigkeit Typ B (%) | |
|---|---|---|---|
| Unauffällig | 28 | 27 | 30 |
| Mediastinalverbreiterung | 49 | 54 | 43 |
| Auffälligkeiten der Aortenkontur | 44 | 42 | 47 |
Sowohl für Männer als auch für Frauen gilt, daß man bei der Vorstellung eines Patienten an die Möglichkeit eines Aortensyndroms denkt und es dann diagnostiziert, bevor tödliche Komplikationen auftreten. Wegen der oft nicht spezifischen Symptomatik und der differentialdiagnostischen Möglichkeit eines akuten Koronarsyndroms bzw. einer TIA bzw. eines Apoplexes ist die Diagnostik oft eine Herausforderung.
Laboruntersuchungen sind für die Diagnose eines akuten Aortensyndroms an sich ohne Bedeutung. Sie sind aber wichtig zur differentialdiagnostischen Abgrenzung der Beschwerden und zur Erfassung lebensbedrohlicher Komplikationen.
| Parameter | Hinweis auf |
|---|---|
| Hb | Blutverlust, Blutung, Anämie |
| Leukozytenzahl | Infektion, systemische Entzündung |
| C-reaktives Protein | Entzündung |
| Procalcitonin | Differenzierung zwischen systemischer Entzündung und Sepsis |
| CK | Rhabdomyolyse, myokardiale Ischämie |
| Troponin I oder T | myokardiale Ischämie, Myokardinfarkt |
| d-Dimere | Aortendissektion, Lungenarterienembolie, Thrombose |
| Kreatinin | Niereninsuffizienz (vorbekannt oder sich entwickelnd) |
| SGOT, SGPT | Leberischämie, Lebererkrankung |
| Laktat | Darmischämie, metabolische Störung |
| Glukose | Diabetes mellitus |
| Blutgase | metabolische Störung, Hypoxie |
In der Regel ist die Bestimmung der d-Dimere die wichtigste Laboruntersuchung für die Diagnose eines akuten Aortensyndroms. Dabei ist ein Wert von <1.600 ng/ml am besten dazu geeignet, um ein klassisches akutes Aortensyndrom innerhalb der ersten 6 Stunden nach Symptombeginn auszuschließen. Man muß aber daran denken, daß ein Wert von <500 ng/ml (Grenzwert für Lungenarterienembolie) auch bei intramuralem Aortenhämatom, penetrierendem aortalen Ulcus und einer Aortendissektion mit Thrombose im falschen Lumen auftreten kann.
Die d-Dimere sind kein spezifischer Labortest, denn er kann auch bei anderen Erkrankungen, wie z.B. einem akuten Myokardinfarkt mit Ausbildung eines muralen LV-Thrombus und bei Lungenarterienembolie erhöht sein.
Die Bestimmung der d-Dimere ist trotzdem ein wertvoller Parameter zum Ausschluß eines akuten Aortensyndroms.
Bildgebung
CT, TEE und MRI sind Methoden, mit denen sich ein akutes Aortensyndrom sehr gut nachweisen lassen. Welche Methode man anwendet hängt davon ab, welche Methode verfügbar ist und in welchem klinischen Zustand sich der Patient befindet (Tab. 6).
| TTE | TEE | MRI | CT | |
|---|---|---|---|---|
| Umfassende Darstellung der Aorta | + | ++ | +++ | +++ |
| 3D-Darstellung | - | - | +++ | +++ |
| Funktionelle Befunde | +++ | +++ | ++ | + |
| Gewebe-Charakterisierung | - | - | +++ | +++ |
| Mobile Einsatzmöglichkeit | +++ | +++ | - | - |
| Zugang/Monitoring des Patienten | +++ | +++ | + | ++ |
| Schnelligkeit der Anwendung | +++ | ++ | ++ | +++ |
| Notwendigkeit zur KM-Gabe | - | - | ++ | +++ |
| Notwendigkeit zur Sedierung | - | +++ | - | - |
| Fehlende Strahlenbelastung | +++ | +++ | +++ | - |
In der Regel ist das CT das Verfahren der Wahl, ein TEE kann ggfs. aber auch sinnvoll sein.
Bei Hochrisiko-Patienten mit unauffälligem Befund der initialen Bildgebung kann es sinnvoll sein, eine 2. Untersuchung durchzuführen, um ein Aortensyndrom definitiv auszuschließen bzw. die Pathoanatomie des Aortensyndroms genauer abzuklären und um die Therapie besser planen zu können. Dennoch benötigen mehr als ⅔ aller Patienten lediglich 1 bildgebende Untersuchungsmethode.
Echokardiographie
Der Einsatz des transthorakalen Echos (TTE) wird in Notfallsituationen zur schnellen Diagnostik oftmals eingesetzt. Aus suprasternaler, subcostaler und abdomineller Sicht kann man einzelne Abschnitte der Aorta, aber auch Anatomie und Funktion des linken Herzens sehen, was oft den schnellen Zugang zu bedeutsamen Befunden und die Möglichkeit zur schnellen Therapieempfehlung schafft.
In vielen Fällen ist es möglich, lebensbedrohliche Komplikationen wie Aortenklappeninsuffizienz, Perikarderguß, Perikardtamponade und linksventrikuläre Wandbewegungsstörungen schnell zu erkennen. Für die Diagnose und Differenzierung eines akuten Aortensyndroms hat diese Untersuchung allerdings eine mit 78% (Typ A-Dissektion) bzw. 30 - 50% (Typ B-Dissektion) geringe Sensitivität. Es ist daher nicht möglich, ein akutes Aortensyndrom bei unauffälligem Echo auszuschließen.
Das transösophageale Echo (TEE) hingegen stellt hingegen mit einer Sensitivität von 99% und einer Spezifität von 89% bei bekanntem oder vermutetem Aortensyndrom eine sehr gute und treffsichere diagnostische Möglichkeit dar. Sein Vorteil gegenüber CT und MRI besteht darin, daß die Untersuchung am Krankenbett durchgeführt werden kann und keinen Einsatz von Kontrastmittel erfordert.
Für die Langzeit-Beobachtung eines Aortensyndroms ist die Methode allerdings weniger als CT oder MRI geeignet, denn hier muß man die gesamte Aorta mit ihren abgehenden Gefäßen beurteilen können und zudem serielle Messungen an leicht zu identifizierbaren Stellen durchführen können.
CT und MRI
Mit Hilfe des CT und des MRI ist es möglich, die gesamte Aorta und ihre abgehenden Äste zu beurteilen. Beide Methoden haben eine hohe Ortsauflösung, zudem gibt es z.B. bzgl. der Projektionen der Abbildung zahlreiche Möglichkeiten der elektronischen Beeinflussung, sodaß die Untersuchung bei akuten Aortensyndromen und ihrer Komplikationen (z.B. Perikard- oder Pleuraerguß) eine große Genauigkeit und Treffsicherheit hat. Im Gegensatz zur Echokardiographie können die genannten CT-Untersuchungen allerdings nicht am Krankenbett durchgeführt werden, was ihren Einsatz vor allem bei instabilen Patienten einschränken kann.
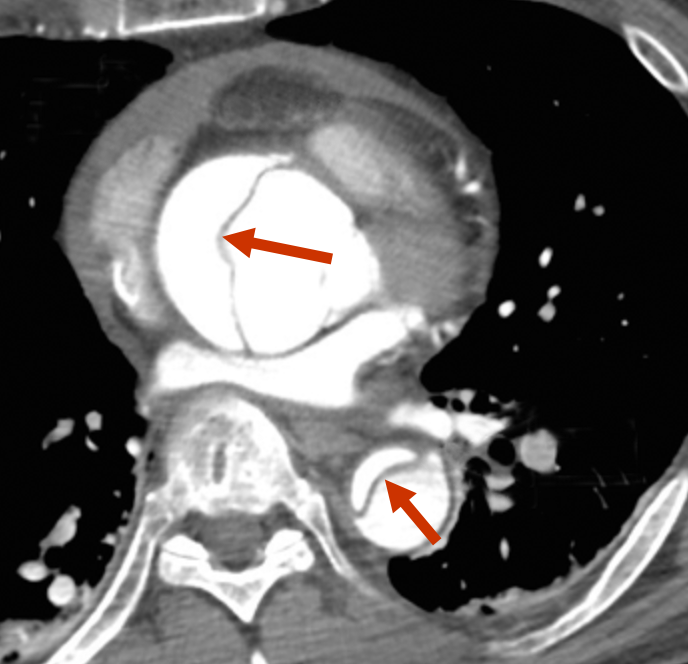 |
 |
| Abb. 3 | |
Links: Querschnitt der Aorta mit Dissektion nin aszendierender und deszendierender Aorta Rechts: Längsschnitt der Aorta mit Dissektionsmembran vom Aortenbogen bis in den Bereich der Nierenarterien |
|
Ein natives Röntgen-CT, gefolgt von einer CT-Angiographie mit Kontrastmittelgabe sollte angesichts seiner hohen Sensitivität (100%) und Spezifität (98%) bei Patienten mit vermutetem Aortensyndrom die Untersuchungsmethode der 1. Wahl darstellen. Dabei sollten Geräte mit mindestens 16 Detektoren benutzt werden, die eine schnelle Bildaquisition ermöglichen. Mit ihrer Hilfe ist es möglich, die für die weitere Behandlung erforderlichen Informationen schnell zu bekommen.
Ein Notfall-CT-Angio ist auch das Verfahren der 1. Wahl bei Patienten mit vermuteter traumatischer Aortenverletzung (Sensitivität und Spezifität ca. 100%). Ist dies nicht möglich könnte alternativ auch ein TEE durchgeführt werden.
In vielen Krankenhäusern besteht heute die Möglichkeit zur Durchführung eines 64-Detektoren-CT, das zur Differentialdiagnose bei Patienten mit akutem Brustschmerz eingesetzt wird. Wegen seines hohen negativ prädiktiven Wertes wird es in diesen Situationen oft zum Ausschluß eines Aortensyndroms, einer Lungenarterienembolie und eines Koronarerkrankung eingesetzt.
Das Röntgen-CT erlaubt auch die Beurteilung aortaler Verkalkungen und kann zur Verlaufskontrolle von Patienten mit Stents in der Aorta verwendet werden.
Aufgrund der schnellen pulsativen Bewegungen der Aortenwand im Verlauf eines Herzzyklus kann es (vor allem bei nicht-EKG-getriggerten Aufnahmen) zur Artefakten bei der Beurteilung der Aortenwand kommen, die fälschlicherweise wie Intimalappen wirken können (sog. Pulsationsartefakte) (Abb. 4).
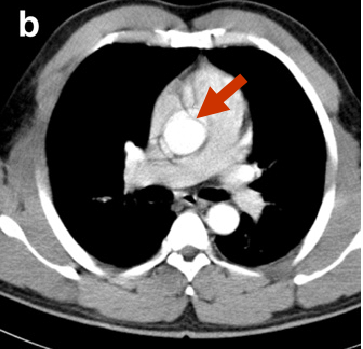 |
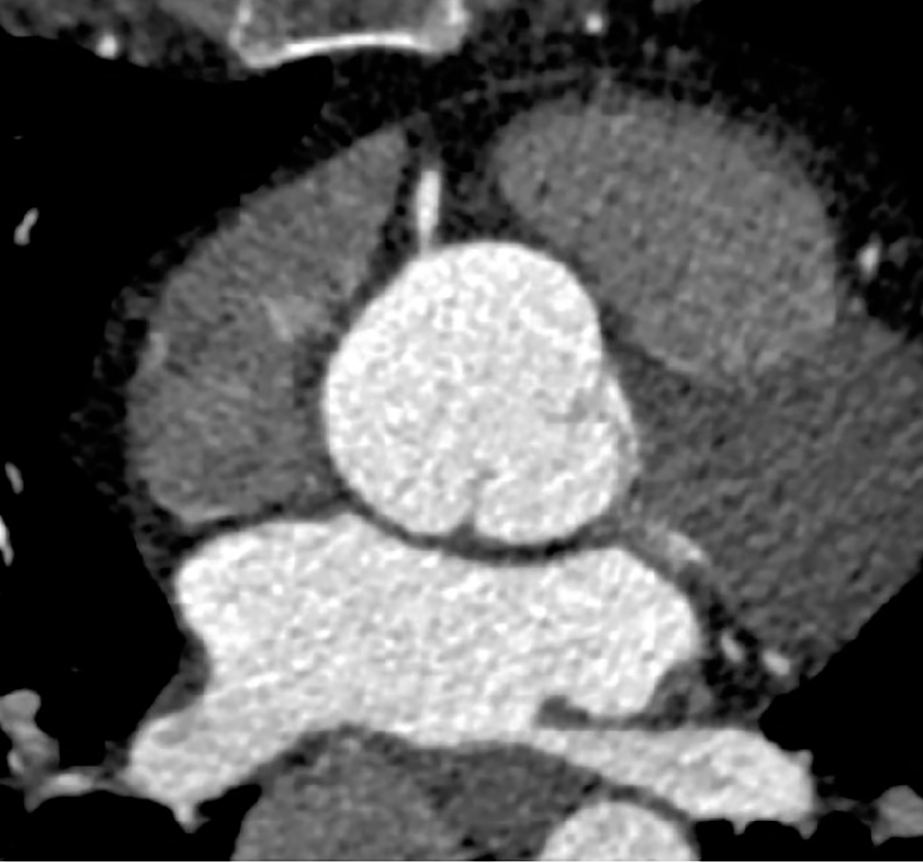 |
| Abb. 4 | |
Links: Pulsationsartefakt, das eine Dissektionsmembran vortäuscht. Rechts: EKG-getriggertes CT ohne Nachweis einer Membran. |
|
Bei der Verwendung von Kontrastmittel für ein Angio-CT muß man stets berücksichtigen, daß die Möglichkeit einer allergischen Kontrastmittelreaktion und der Auslösung bzw. Verschlechterung einer Niereninsuffizienz besteht. Zudem muß man berücksichtigen, daß vor allem bei seriellen Untersuchungen über Jahre hinaus vor allem bei Frauen und jungen Menschen ein canceroges Risiko besteht.
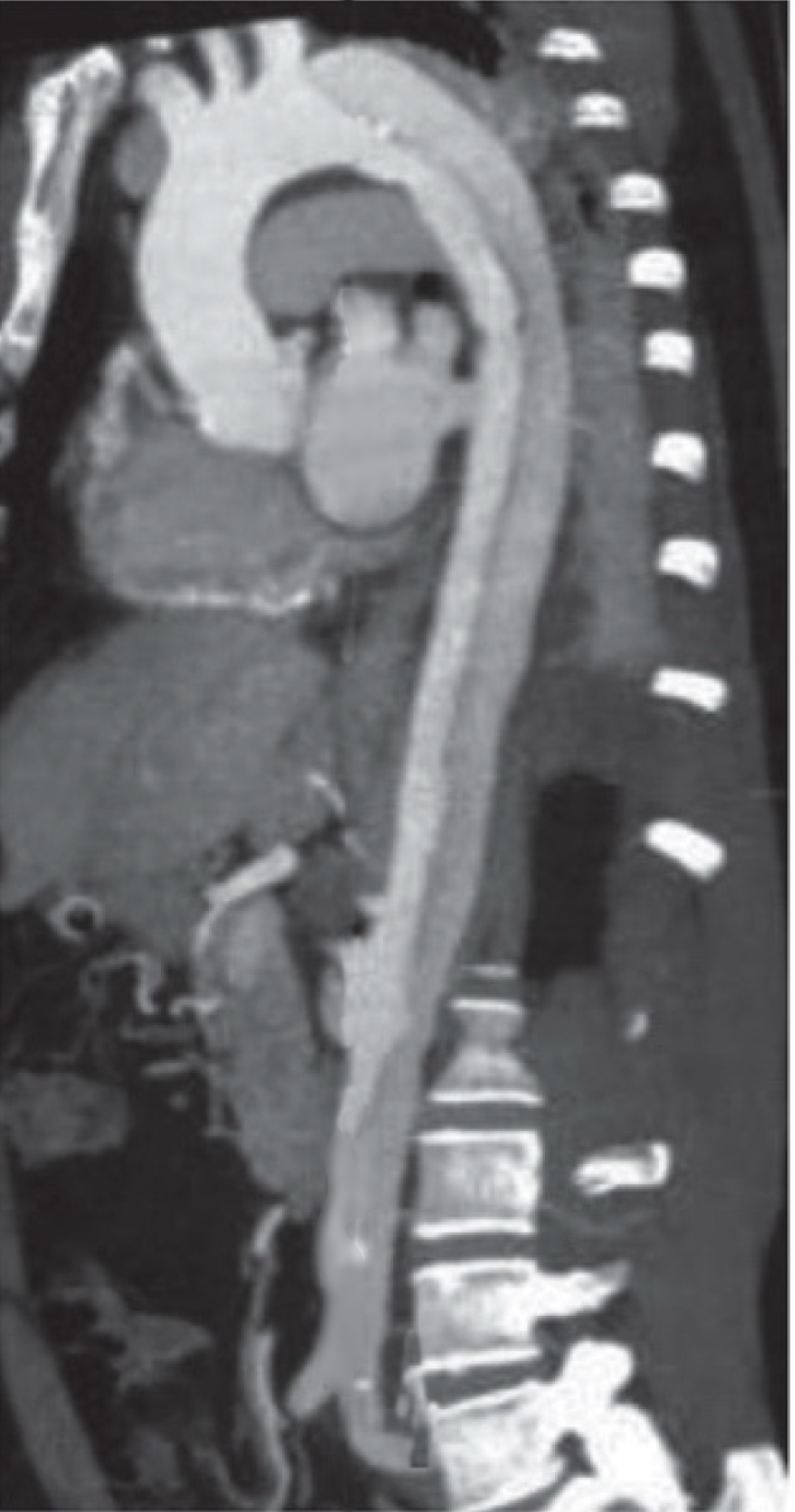
Auch MR-Untersuchungen haben mit einer Sensitivität und Spezifität von jeweils ca. 98% eine hohe diagnostische Treffsicherheit bei der Untersuchung von Patienten mit vermutetem Aortensyndrom (Abb. 5).
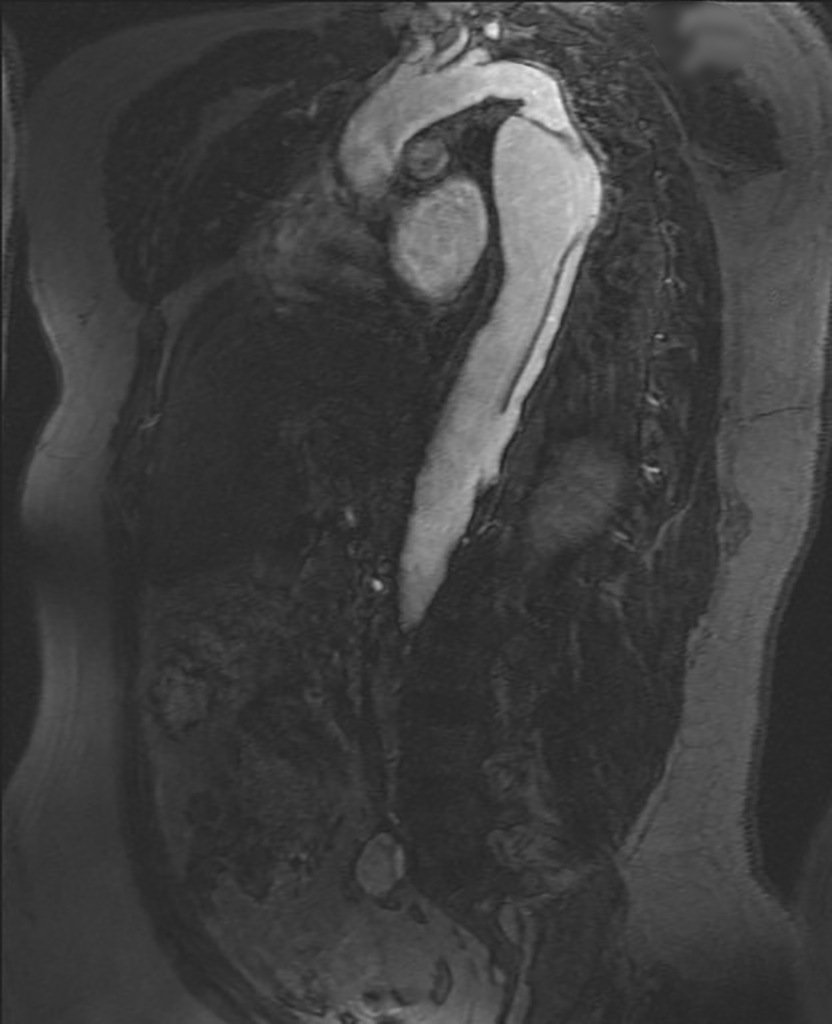
Abb. 5
Dissektionsmembran im MRI
Neben der Beurteilung der Anatomie der Aortenwand bietet ein MR-CT aber auch die Möglichkeit, eine vor allem bei einer Typ A-Aortendissektion häufig auftreten Aortenklappeninsuffizienz festzustellen und zu quantifizieren. Hierzu wendet man die Phasenkontrastangiographie mit Geschwindigkeitscodierung („Velocity Encoding“) zur Darstellung und Quantifizierung des Blutflusses.
Zudem kann man mittels spezieller MR-Techniken (time-resolved angiographic techniques und cine bright blood images) den Blutfluß im richtigen und falschen Lumen einer Aortendissektion beurteilen.
Bei der Anwendung einer MR-Untersuchung muß man berücksichtigen, daß ferromagnetische „Nebenwirkungen“ bei evtl. vorhandenen eisenhaltigen Implantaten, die Möglichkeit einer magnetischen Beeinflussung von Schrittmachern oder implantierten Defibrillatoren und Platzangst die Durchführung der Untersuchung verhindern können.
Auch muß man bei der Verlaufskontrolle von Patienten, die mittels Aortenrohr- bzw. Klappenprothesen oder mit Aortenstents behandelt wurden berücksichtigen, daß es zu erheblichen Bildartefakten kommen kann, die die Beurteilung der Aortenwand beeinträchtigen können.
Das für MR-Untersuchungen benutzte Kontrastmittel Gadolinium ist weniger nephrotoxisch als jodhaltiges Kontrastmittel. Gadolinium kann eine systemische Nierenfibrose auslösen, wobei diese Komplikation aber nur sehr selten auftritt und zudem Patienten mit fortgeschrittener Niereninsuffizienz betrifft.
Aufgrund einer mit 20 - 30 min langen Untersuchungsdauer für die Untersuchung der Aorta ist eine MR-Untersuchung aber in Notfallsituationen und bei instabilen Patienten weniger gut geeignet als ein konventionelles Röntgen-CT.
Verglichen mit dem Röntgen-CT stellt eine MR-Untersuchung eine sehr gute Möglichkeit dar, Patienten mit vermutetem Aortensyndrom oder bekannter Aortenerkrankung zu untersuchen, ohne ionisierende Strahlung oder jodhaltiges Kontrastmittel einsetzen zu müssen.
Andere Techniken
Intravaskularer Ultraschall
Diese Methode ermöglicht es, die Aorta und ihre Pathologie in Echtzeit darzustellen. Sie ist eine verläßliche und sichere Untersuchungsmethode bei der Positionierung eines Aortenstents.
Wie das TEE kann man die Stelle der Plazierung eines Stents, den Abgang von aortalen Nebengefäßen, den intimalen Einriß der Aortenwand bei einer Dissektion, intramurale Hämatome und den Aneurysmasack selber gut beurteilen.
Nachteile der Methode sind die fehlende Möglichkeit zu DOPPLER-Untersuchungen und die ebenfalls fehlende Möglichkeit, außerhalb des Bildzentrums Messungen durchführen.
Es besteht jedoch die Möglichkeit, die Verbindung zwischen dem echten und dem falschen Lumen einer Dissektion darzustellen und um Fenestrationsbehandlungen zu planen.
Positronen-Emissions-Tomographie (PET)
Die Verwendung von 18F-Fluorodeoxyglukose (18F-FDG) beim PET stellt eine Möglichkeit dar, einen entzündlichen und/oder infektiösen Vorgang in der Aortenwand darzustellen.
Die heute übliche Kombination der PET mit einer CT-Angiographie oder einem MRI hat die Ortsauflösung des PET erheblich verbessert, sodaß es besser möglich ist, murale oder luminale Befunde in der Aortenwand gut darzustellen.
Eine vermehrte Aufnahme von 18F-FDG in der Wand einer akut disseziierten Aorta hilft zusammen mit serologischen Entzündungsparametern (d-Dimere, C-reaktives Protein) und Parameter, die Bildung und Auflösung von Thromben und die Aktivierung von Thrombozyten anzeigen (z.B. P-Selectin, Thrombin–Antithrombin III Komplexe, Plasmin–alpha2–Antiplasmin Komplexe und d-Dimere) anzeigen dabei, im Rahmen von Verlaufsuntersuchungen mögliche Risikopatienten zu identifizieren.
Aortographie und Coronarographie
Angesichts ihrer hohen Sensitivität (ca. 90%) und Spezifität (%gr´t;95%) war die retrograde Aortographie früher das Verfahren der 1. Wahl bei Patienten mit vermutetem akuten Aortensyndrom. Angesichts ihres invasiven Charakters, seiner Risiken, der Zeitintensität und der Kosten ist sie allerdings heute in den Hintergrund getreten (außer in denjenigen Fällen, in denen ohnehin die Indikation zur Coronarographie oder zu endovaskulären Interventionen besteht). Heute ist die Aortographie von den nicht invasiven bildgebenden Verfahren abgelöst worden.
Bei ca. 20% aller Patienten mit Typ A-Dissektion sind auch die Koronararterien betroffen. Ursache dafür ist, daß der Abgang von rechter und linker Koronararterie in die Dissektion einbezogen werden und/oder daß sich Dissektion aus der Aortenwurzel weiter in den Verlauf der Arterien „vorwühlt“.
Dabei spielt es keine Rolle, ob eine arteriosklerotische Koronarerkrankung vor dem Auftreten des Aortensyndroms vorlag oder nicht. Dennoch wird eine Coronarographie vor der operativen Korrektor der Aortenkrankheit nicht empfohlen. Die Coronarographie würde nämlich die notfallmäßige Operation der Aortenerkrankung verzögern, sie ist oft technisch schwierig und bedeutet das erhöhtes Risiko eine zusätzlichen Verletzung der Aortenwand.
Auch wenn das Aortensyndrom in einigen Fällen mit einer arteriosklerotischen Koronarerkrankung gemeinsam vorliegt und auch wenn das EKG in einigen Fällen mit Aortensyndrom die Zeichen myokardialer Ischämien oder sogar eines Infarktes zeigt hat eine präoperative Coronarographie dennoch nicht zu einer bedeutsamen Verbesserung der Kurz- und Langzeit-Mortalität geführt. Die Durchführung einer Coronarographie sollte daher auf solche Patienten beschränkt werden, bei denen eine KHK bereits bekannt ist, die koronare Bypass-Gefäße haben und die die Zeichen einer frischen myokardialen Ischämie oder eines frischen Myokardinfarktes zeigen und bei denen die Chirurgen genauere Informationen über die Koronaranatomie wünschen, um den aortalen Eingriff besser planen zu können.
Diagnostischer Algorithmus
In der Notfallsituation eines vermuteten oder vermuteten Aortensyndroms ist die schnelle Durchführung der folgenden Untersuchungen erforderlich:
- Abschätzung der Wahrscheinlichkeit eines akuten Aortensyndroms
- Labor: d-Dimere, Troponin
- Röntgen-Thorax und
- EKG.
Auf der Basis dieser Maßnahmen muß nachfolgend über die schnelle (!) Durchführung bildgebender Verfahren (TTE + CT und/oder TEE) (Abb. 7).
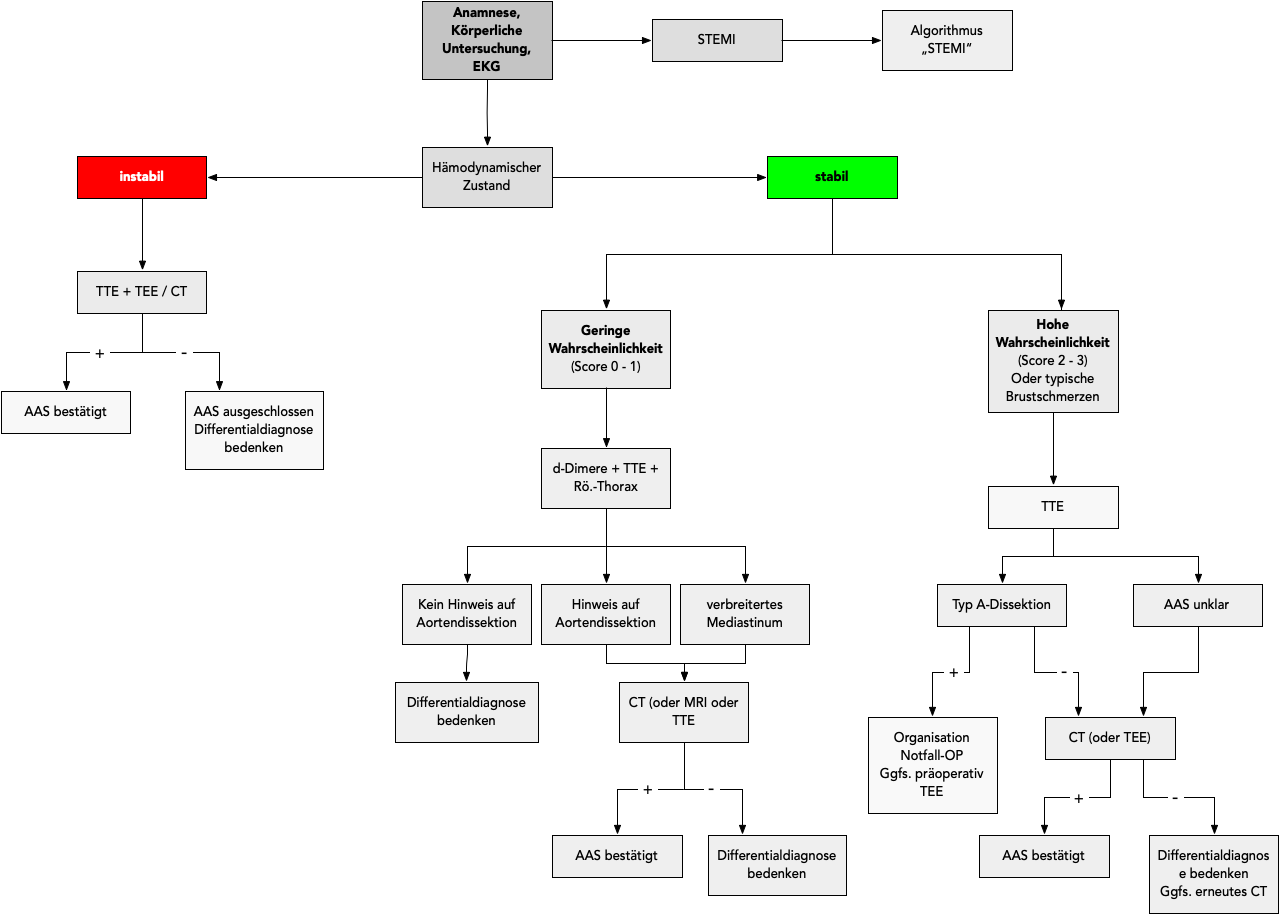
Basierend auf prädisponierenden Faktoren, Schmerzcharakteristika und Untersuchungsbefunden teilt man das Risiko bei Patienten mit Verdacht auf ein Aortensyndrom nach dem Aortic Dissection Detection Risk Score (ADD) ein (Tab. 7).
| Anamnestische Hochrisikofaktoren |
|
| Hochrisikosymptome |
|
| Hochrisikobefunde |
|
Dabei wird pro Kategorie maximal 1 Punkt vergeben, sodaß eine maximale Gesamtpunktzahl von 3 möglich ist. Bei einem ADD = 0 liegt ein niedriges, bei ≤1 ein mittleres und bei 2 - 3 ein hohes Risiko vor.
Dieser Score hat eine diagnostische Sensitivität von ca. 96% dafür, daß ein akutes Aortensyndrom vorliegt.
Von denjenigen Patienten mit einem Score von 0 hatten etwa die Hälfte im Röntgen-Thorax ein erweitertes Mediastinum. Die Gültigkeit dieses Score im klinischen Alltag muß allerdings noch durch weitere klinische Studien erwiesen werden.
Ebenfalls ist derzeit noch nicht klar, welche Bedeutung die Bestimmung der d-Dimere zusätzlich zu Anamnese und den oben genannten Untersuchungsmethoden einschließlich der Bestimmung des oben genannten ADD-Scores hat. Das Wissen hierum würde dabei helfen, diejenigen Patienten mit niedrigem oder mittlerem ADD-Risiko-Score zu identifizieren, bei denen die jeweils vorhandenen bildgebenden Verfahren (TTE und CT und/oder TEE) einzusetzen sind, das Aortenteam alarmiert werden muß oder die in ein Zentrum verlegt werden müssen, in denen alle diagnostische Möglichkeiten und eine adäquate Behandlung möglich ist.
Behandlung
Bei allen Patienten, die sich mit dem Verdacht auf ein akutes Aortensyndrom vorstellen ist es erforderlich, unabhängig von der definitiven Therapie (OP? Stent?) bereits sehr früh eine medikamentöse Therapie zur Verminderung der Wall stress einzuleiten. Diese Behandlung soll die weitere Vergrößerung der Dissektion und eine Ruptur der Aorta verhindern.
Hierzu ist es erforderlich, die Schmerzen zu lindern (intravenöse Opiate), die Herzfrequenz auf <60/min zu reduzieren und den systolischen Blutdruck auf 100 - 120 mm Hg einzustellen. Zur Frequenz- und Blutdruckeinstellung werden hauptsächlich intravenöse ß-Blocker (z.B. Propranolol, Metoprolol, Labetalol oder Esmolol) in einer auf den jeweiligen Patienten abgestimmten Dosis eingesetzt.
Non-Dehydropyridin-Calcium-Antagonisten (Verapamil, Diltiazem) sind eine Alternative bei Patienten, die keinen ß-Blocker vertragen oder die Kontraindikationen für ihren Einsatz haben.
In einigen Fällen kann es notwendig sein, Vasodilatatoren (Natriumnitroprussid i.v.) zusätzlich zu einem ß-Blocker einzusetzen, um den arteriellen Blutdruck schnell zu senken. Der ß-Blocker ist hierbei notwendig, um die Reflextachykardie und eine erhöhte Inotropie, die mit dem Beginn der Vasodilatationstherapie einsetzt zu blockieren.
Bzgl. der weiteren „definitiven“ Therapie bestehen z.Z. 3 Behandlungsansätze:
- Operation
- Stenting und
- Hybrideingriffe.
Bei Typ-A-Dissektion ist in der Regel der sofortige operative Ersatz der Aorta ascendens indiziert.
Grundsätzlich ist dabei eine klappenerhaltende Operation wünschenswert. Bei einer Destruktion der Aortenwurzel ist jedoch in der Regel ihr kompletter Ersatz mittels klappentragendem Conduit notwendig.
Unkomplizierte und stabile Typ B-Dissektionen der deszendierenden Aorta werden primär medikamentös durch die Senkung bzw. Kontrolle des Blutdrucks behandelt. Im Verlauf der letzten Jahre besteht aber der zunehmende Trend zum Stenting.
Dabei wird die Kenntnis genutzt, daß die Prognose von Dissektionen durch Thrombosierung des falschen Lumens deutlich gebessert wird. Durch den Verschluß der Intimaeinrissstellen bewirken Aortenstents eine Thrombosierung des falschen Lumens, die zunehmende Verkleinerung des falschen mit anteiliger Vergrößerung des wahren Lumens und damit eine Stabilisierung des Aortenrohres.
Verwendet werden Stents von 10 bis 14 cm Länge und 30 bis 44 mm Durchmesser, die unter Vollnarkose implantiert werden.
Es ist dabei allerdings zu berücksichtigen, daß das ein Stenting bei stabilen Typ B-Dissektionen keinen nachgewiesenen Einfluß auf die Sterblichkeit im Rahmen des Krankenhausaufenthaltes hat und daß der Stellenwert einer Stent-Therapie in diesen Fällen noch nicht klar erwiesen ist.
Bei Instabilität einer Typ B-Dissektion hingegen, d.h. wenn
- die Schmerzen unter laufender medikamentöser Therapie persistieren oder aufgrund zunehmender Aortendilatation rezidivierend auftreten
- bei zunehmender Vergrößerung des Dissekates
- progredienter periaortaler und/oder aortaler Hämatombildung
- bei Entwicklung einer Typ-A-Dissektion
- beim Auftreten von Organ- oder Extremitätenischämien oder
- bei Anzeichen für eine Ruptur (Hämatothorax, zunehmendes periaortales oder mediastinales Hämatom)
besteht die Indikation zu Operation oder Stenting. Insgesamt ist nur bei wenigen Patienten mit Typ B-Dissektion eine Operation notwendig, und zwar dann, wenn ein Stenting kontraindiziert oder nicht durchführbar ist.
Bezüglich einer offenen Operation muß man berücksichtigen, daß sie eine hohe Mortalität hat (25 - 50%!) und daß ein hohes Risiko für schwere Komplikationen (Rückenmark-Ischämie, Apoplex, mesenteriale Ischämie oder Infarkte und Niereninsuffizienz) haben.
Wenn eine Operation nicht möglich ist besteht die Alternative in einer perkutanen Intimamembran-Fensterung (PFA) mit Implantation eines Aortenstents.
Das Verfahren wird bei Organ- oder Extremitätenischämie eingesetzt, die aufgrund einer Kompression des wahren Lumens durch das falsche Lumen entsteht.
Bei diesem Verfahren wird vom wahren Lumen aus mittels einer BROCKENBROUGH-Nadel die Intimamembran durchstoßen, ein 12 bis 15 mm dicker Ballon eingeführt und die Punktionsstelle aufgedehnt. Dadurch lässt sich die Ischämiesymptomatik oft innerhalb weniger Minuten beseitigen. Postinterventionell muß allerdings mit Reperfusionsschäden, wie beispielsweise einem Crush-Syndrom der Nieren gerechnet werden. PFA und Stentimplantation werden auch als Hybrideingriffe vor oder nach einem operativen Eingriff durchgeführt.
Auch nach einem Stenting sind Komplikationen in der Gestalt eines Postimplantations-Syndroms möglich (ca. 15 - 16%). Hierunter versteht man das Auftreten von Fieber >380 C, Leukozytose von >12.000/nl und eine Erhöhung des C-reaktiven Proteins auf %gt;10 mg% innerhalb von 72 h nach der Stentimplantation bei negativer Blutkultur. Das Ergebnis des Stenting im Rahmen der Krankenhausbehandlung wird durch das Auftreten des Postimplantations-Syndroms nicht beeinträchtigt und auch die Mortalität ist auch im Verlauf von 4 Jahren nach dem Stenting nicht erhöht. Jedoch ist das Risiko von Komplikationen (Aortenruptur, Notwendigkeit zur erneuten Intervention) innerhalb von 4 Jahre erhöht, ohne daß dies zu einer Erhöhung der Mortalität führen würde. Die Gründe für das Auftreten dieses Syndroms ist ebenso unklar wir die Antwort auf die Frage, ob in diesen Fällen der Einsatz von Corticosteroiden sinnvoll ist.
Eine offene Operation wird vor allem bei Patienten mit Typ A-Dissektion erforderlich sein. Sie führt dazu, daß die gesamte Mortalität auf mittlerweile 22% gesunken ist, was vor allem auf die im Verlauf ihrer Entwicklung abnehmende OP-Sterblichkeit (18%) zu beziehen ist. Auch ältere Patienten und solche mit komplexen Typ A-Dissektionen werden heute operiert.
Im Vergleich zu der im Verlauf der Zeit verminderten Sterblichkeit bei operierten Patienten ist die Sterblichkeit bei medikamentös behandelten Patienten mit bis zu 55% unverändert hoch.
Die häufigsten Gründe, warum ein Patient nicht operiert wird sind sein fortgeschrittenes Lebensalter, seine Co-Morbidität oder die Ablehnung der Operation durch den Patienten.
Weil Patienten in vielen Fällen bereits vor Überlegungen bzgl. einer Operation oder vor der Operation selber sterben ist es wichtig, daß eine Operation so schnell wie irgendwie möglich erfolgt, weil die Prognose ansonsten fatal ist. In diesem Zusammenhang sollte erwogen werden, Hybrid-Operationen mit Stenting und einer Fenestrierung der Dissektion durchzuführen.
Hinzuweisen ist schließlich noch auf die Notwendigkeit, alle Patienten mit akuten Aortensyndromen während des Krankenhausaufenthaltes engmaschig klinisch, mittels Labor und bildgebenden Verfahren (bevorzugt CT oder MRI) zu überwachen, um frühe Zeichen einer Progression der Erkrankung und das Auftreten von Durchblutungsstörungen schnell zu erkennen.
Langzeit-Verlauf
Die 10-Jahres-Überlebensrate beträgt bei Patienten mit Aortendissektion, die eine Operation überlebt haben 30 - 60%. Es ist eine Erkrankung, die wegen des erhöhten Risikos für eine erneute Dissektion, Ausbildung eines Aortenaneurysmas und einer Ruptur auch nach primär erfolgreicher Operation ein lebenslanges Problem darstellt. Daher müssen Patienten nach einem Aortensyndrom unabhängig von der initialen Therapie (medikamentös, Operation oder Stenting) lebenslang klinisch und mittels bildgebender Verfahren beobachtet und überwacht werden. Die Patienten müssen über die Art ihrer Erkrankung und die Komplikationsmöglichkeiten im weiteren Verlauf genau informiert werden und es ist zudem ratsam, auch die Familienangehörigen zu untersuchen.
Zu den möglichen Spätkomplikationen akuter Aortensyndrome gehören:
- Progrediente Aortenklappeninsuffizienz
- Progressive Zunahme des Aortendurchmessers mit Ausbildung eines Aortenaneurysmas und Aortenruptur
- Wiederholte oder sich ausbreitende Dissektion
- Leckagen mit Blutungen an aortalen OP-Nähten oder Rändern eines Stent
- Durchblutungsstörungen
Dabei tragen Patienten mit
- MARFAN-Syndrom durch ein sehr hohes Risiko für wiederholte Dissektionen oder Aneurysma-Bildung mit Ruptur und
- Patienten mit durchgängigem falschen Lumen einer Aortendissektion ein erhöhtes Risiko für Spätkomplikationen und Tod.
Auch wenn die Gefahr aortaler Komplikationen (vor allem eine Vergrößerung des falschen Lumens) primär in den ersten Monaten nach dem akuten Ereignis erhöht ist wird allgemein empfohlen, den Verlauf mittels CT oder MRI (wegen der Möglichkeit zur genauen Beurteilung der Aorta und ihrer Nebenäste) regelmäßig zu kontrollieren. Dazu wird vorgeschlagen, diese Untersuchungen
- vor Entlassung aus dem Krankenhaus
- nach 1 • 3 Monaten
- 6 Monaten und
- 12 Monaten
durchzuführen.
Nachfolgend sollten Kontrollen in jährlichen Abständen erfolgen, wobei der klinische Zustand des Patienten, der Durchmesser der Aorta und eine evtl. Zunahme des Aortendurchmesser diese Kontrollintervalle natürlich verändern können.
Obwohl es deutlich teurer ist sollte bei den Verlaufskontrollen einer MR-Untersuchung vor allem bei jungen Patienten wegen der im Verlauf hohen Strahlenbelastung der Vorzug gegeben werden.
Bildgebende Verlaufskontrollen sollten nach Möglichkeit stets in derselben Röntgenabteilung bzw. -praxis erfolgen, weil dies den genauen Vergleich der Bilder und Befunde erheblich vereinfacht und verläßlicher macht.
Der Stellenwert von Matrix-Metalloproteinasen und der Blutspiegel von transformierende ß-Wachstumsfaktoren ist zur Verlaufskontrolle noch nicht klar.
Das Haupt-Augenmerk für die Langzeit-Behandlung von Patienten mit Aortensyndromen muß auf die Einstellung des arteriellen Blutdrucks auf <120/80 mm Hg und der Herzfrequenz auf <60/min mittels ß-Blockern gerichtet sein. Dabei sollten lang wirksamen ß-Blockern der Vorzug gegenüber kurz wirksamen Medikamenten gegeben werden, weil dies zu einer Verminderung von Nebenwirkungen und zur Verbesserung der Einnahme-Compliance führt.
Die meisten Patienten benötigen eine Kombination von mindestens 2 Medikamenten, um Blutdruck und Herzfrequenz ausreichend einzustellen. Gelingt dies alleine mit ß-Blockern nicht oder besteht eine „echte“ Intoleranz gegenüber ß-Blockern können alternativ auch ACE-Hemmer oder AT1-Antagonisten eingesetzt werden; diese sind allerdings Medikamente der 2. Wahl. Auch können lang wirksame Calcium-Antagonisten zusammen mit ß-Blockern als Medikamente der 3. Wahl eingesetzt werden, um das therapeutische Ziel einer optimalen Blutdruckeinstellung zu erreichen.
Patienten mit einer arteriosklerotischen Erkrankung der thorakalen Aorta sollten als KHK-Risikopatienten angesehen werden und entsprechend auch mit Statinen behandelt werden. Neben dem Cholesterin-senkenden Effekt wird diesen Medikamenten auch eine Wachstumsverlangsamung eines thorakalen Aortenaneurysmas und eine Risikoverminderung für Dissektionen, Rupturen und Todesfällen zugeschrieben.
| Medikamentöse Therapie |
|
|
|
|
Es ist selbstverständlich, daß allen Patienten nach einem akuten Aortensyndrom die Aufgabe des Zigarettenrauchens und die eher strenge Einstellung der arteriosklerotischen Risikofaktoren empfohlen werden sollte.
| Informationen für Patienten | Aufklärung der Patienten über Ursache, Art und möglichen Verlauf der Erkrankung |
| Hinweise auf Notwendigkeit zur gewissenhaften Med.-Einnahme | |
| Genetische Beratung | |
| Aufgabe des Zigarettenrauchens und strenge Einstellung arterieller Risikofaktoren | |
Vermeidung von:
|
|
| Keine Einschränkung für mäßige aerobe Tätigkeiten oder Aktivitäten des täglichen Lebens |
Ebensolches Vorgehen bei Verlaufskontrollen, Therapie und Verhaltensempfehlungen gilt auch für das intramurale Hämatom und das penetrierendes aortales Ulcus.
Andere Aortenerkrankungen
Das intramurale Aortenwandhämatom und das ulzerierende Aortenulcus sind Erkrankungen, die ebenfalls dem akuten Aortensyndrom zugeordnet werden. Sie haben eine ähnliche Klinik, haben auch eine unterschiedliche Prognose und ebenfalls unterschiedliche therapeutische Ansätze.
Aortendissektion und intramurales Hämatom betreffen primär die Media der Aorta, während beim ulzerierenden Ulcus die Intima betroffen ist. Der Verlauf dieser beiden Erkrankungen ist sehr variabel, sind aber infolge des Auftretens einer Aortendissektion, eines Aortenaneurysmas und/oder einer Ruptur ebenfalls oft tödlich. Daher gelten für diese Patienten dieselben Empfehlungen bzgl. klinischer und bildgebender Verlaufskontrollen wie für die Patienten mit klassischen Dissektionen.
Intramurales Hämatom
In 5 - 25% aller Fälle liegt dem akuten Aortensyndrom ein intramurales Hämatom zugrunde. es ist gekennzeichnet durch das Auftreten einer Blutung innerhalb der Aortenwand ohne einen intimalen Einriß und ohne ein falsches Lumen.
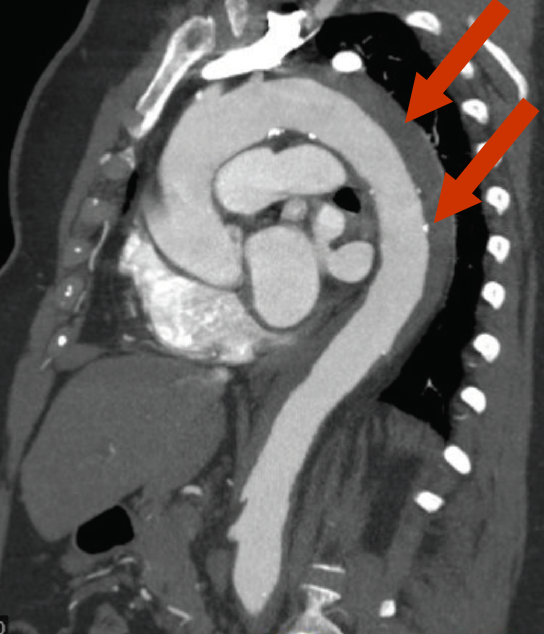
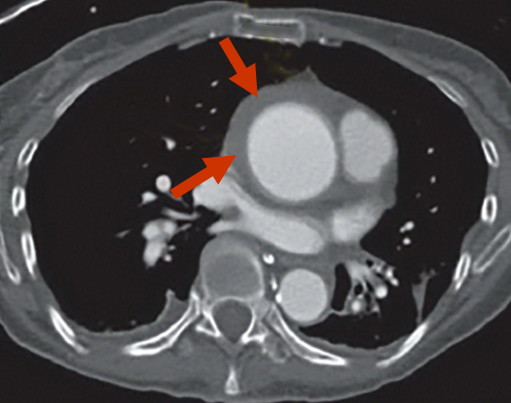
Das diagnostische Charakteristikum ist eine zirkuläre oder halbmondförmige Verdickung der Aortenwand auf >5 mm ohne den Nachweis fließenden Blutes in den bildgebenden Verfahren (Abb. 8, 9).
 |
 |
| Abb. 8 | Abb. 9 |
Intramurales Aortenhämatom |
Intramurales Aortenhämatom Beachten Sie, daß die Aortenwand vorne und rechts lateral gegenüber der Hinterwand verdickt ist. |
Die Untersuchungsmethoden der Wahl sind CT und MRI. Die Kombination eines nativen CT mit nachfolgender KM-Gabe hat eine Sensitivität von ca. 96%. Das intramurale Hämatom wird mit 60 - 70% überwiegend in der deszendierenden thorakalen Aorta (Typ B) beobachtet und tritt wesentlich seltener in der aszendierenden Aorta (30%, Typ A) und im Aortenbogen (10%) auf.
Patienten mit intramuralem Hämatom haben eine ähnliche Klinik und ähnliche Risikofaktoren wie Patienten mit klassischer Aortendissektion, es überwiegt aber aber ein akut auftretender schmerz in Brust und Rücken. Patienten mit intramuralem Hämatom sind in der Regel älter als Dissektionspatienten und haben seltener Aortenklappeninsuffizienzen, Pulsdefizite, akute Myokardinfarkte und Aortenaneurysmata als Patienten mit Dissektionen.
Intramurale Hämatome können sich progressiv entwickeln und dann auch zu klassischen Aortendissektionen (28 - 47%) und oder Aortenrupturen (20 - 45%) führen, während spontane Rückbildungen nur in etwa 10% aller Fälle gesehen werden.
Wenn beim Typ A die aszendierende Aorta betroffen ist ist die akute Sterblichkeit mit bis zu 40% hoch, was auf die Nähe des Hämatoms zur Aortenklappe zu erklären ist. Daher ist in diesen Fällen eine dringliche Operation erforderlich.
Ein abwartendes Vorgehen ohne Operation, jedoch mit optimaler Einstellung des Blutdrucks, intensiver Schmerztherapie und kurzfristigen bildgebenden Verlaufskontrollen kann in einzelnen Fällen erwogen werden, wenn das Operationsrisiko sehr hoch (ältere Patienten und schwere Begleiterkrankungen), bei kleineren Aortendurchmessern (<50 mm) und bei nur geringer Verdickung der hämatösen Aortenwand (<11 mm).
Typ A-Hämatome werden zu Beginn häufiger medikamentös behandelt und haben eine geringere Sterblichkeit. Typ B-Hämatome haben seltener ungünstige Ausgänge und eine Krankenhaussterblichkeit von <10%.
Bei unkomplizierten Typ B-Hämatomen wird eine initiale medikamentöse Therapie mit nachfolgender engmaschiger CT- bzw. MRI-Kontrolle empfohlen. In komplizierten Fällen wird eine Stentbehandlung einer offenen Operation vorgezogen, wenn dies aus anatomischen Gründen und ausreichenden arteriellen Zugangsmöglichkeiten möglich ist.
Zeichen eines komplizierten Verlaufes sind persistierende Schmerzen trotz adäquater medikamentöser Therapie, hämodynamische Instabilität, Zeichen einer Aortenruptur (periaortale Blutung), ein >10 mm tiefer „Krater“ in der Aortenwand, ein Aortendurchmesser von >55 mm und/oder eine schnelle Zunahme des Aortendurchmessers während des Krankenhausaufenthaltes.
Penetrierendes aortales Ulcus
Es handelt sich dabei um die Ulceration eines arteriosklerotischen Plaque in der Aorta, der die Lamina elastica interna in die Media durchbrochen hat. Ein solches Ulcus ist oft mit einem intramuralen Hämatom kombiniert.
Aortale Ulcera treten oft als multiple Befunde auf und sind hinsichtlich ihrer Größe sehr unterschiedlich (>5 mm Durchmesser, 4 - 40 mm Tiefe). Sie können an jeder Stelle der Aorta auftreten, am häufigsten aber in der mittleren und unteren Aorta, seltener im Aortenbogen und der abdominalen Aorta und sehr selten auch in der aszendierenden Aorta.
Man schätzt, daß in etwa 2 - 7% aller Aortensyndrome solche penetrierenden aortalen Ulcera zugrund liegen.
Typischerweise sind Patienten mit aortalen Ulcera >70 Jahre älter als Patienten m it Aortendissektionen und sie haben oft eine diffuse und schwere Form arteriosklerotischer Gefäßkrankheiten, die neben der Aorta auch die Koronararterien betrifft. Zusätzliche Begleiterkrankungen sind arterielle Hypertonie, COPD und Niereninsuffizienz und Patienten mit aortalen Ulcera sind häufig Zigarettenraucher.
Das klinische Bild der Patienten ähnelt demjenigen der klassischen Dissektion. Wegen der eng umschriebenen Lokalisation des Ulcus findet man Aortenklappeninsuffizienz, Pulsdefizite und viszerale Ischämien eher selten.
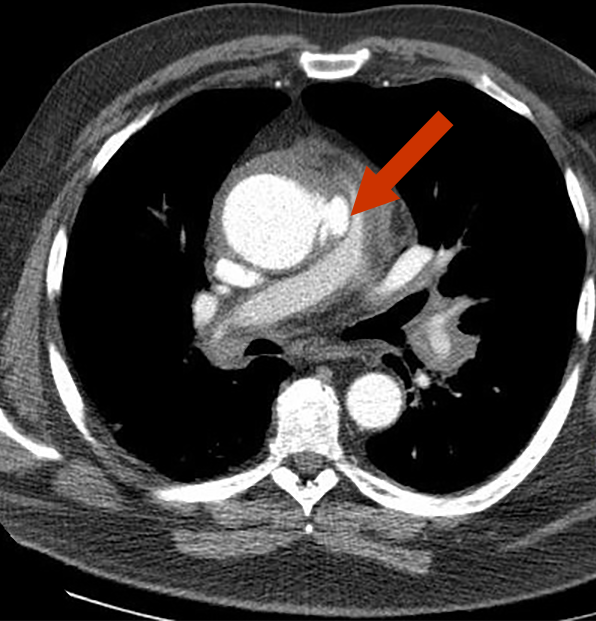
Bzgl. der bildgebenden Verfahren ist eine CT-Angiographie mit Verwendung von Kontrastmittel die Untersuchungstechnik der Wahl.
Man findet asymptomatische aortale Ulcera oft als Zufallsbefund im CT, Echo oder MR. Unklar ist bis heute, ob es Parameter gibt, anhand derer solche Ulcera identifiziert werden können, die im weiteren natürlichen Verlauf das Risiko schwerwiegender Komplikationen wie intramurale Hämatomen, Dissektionen, falsche Aneurysmata oder transmurale Rupturen tragen. Daher läßt sich nicht entscheiden, welche der zufällig festgestellten Ulcera weiter beobachtet und sogar behandelt werden müssen.
Hinzuweisen ist in diesem Zusammenhang darauf, daß die Gefahr einer Aortenruptur im Vergleich zur Aortendissektion deutlich erhöht ist (Risiko bei Typ A-Dissektion: 7%, Typ B-Dissektion: 4%, penetrierendes Ulcus: bis 40%). Daher sollte die weitere Behandlung individuell für jeden Patienten entschieden werden, wobei klinischer Zustand und evtl. Begleiterkrankungen zu berücksichtigen sind.
Gegenwärtig wird empfohlen, ein Ulcus im Bereich der aszendierenden Aorta zu operieren und Ulcera in der deszendierenden thorakalen Aorta medikamentös zu behandeln und im weiteren Verlauf mittels bildgebender Verfahren engmaschig und regelmäßig zu kontrollieren.
In komplizierten Fällen, d.h. bei Hinweisen auf eine drohende oder bereits eingetretene Aortenruptur wird die Implantation eines Stent einer operativen Therapie vorgezogen. Dabei müssen allerdings die anatomischen Besonderheiten des Ulcus, seine Lokalisation und das Risikoprofil der Patienten berücksichtigt werden. Zu dieser Frage (OP vs. Stenting) gibt es allerdings keine klinischen Studien.
Abschließende Bemerkungen
Obwohl Diagnostik und Therapie des akuten Aortensyndroms in den vergangenen Jahren erhebliche Fortschritte gemacht haben bleiben Mortalität und Morbidität hoch.
Die Sterblichkeit des akuten Aortensyndroms ist sehr zeitabhängig: Bei Typ A-Dissektionen beträgt sie innerhalb der ersten 48 Stunden 1 - 2%/h. Die sehr frühzeitige Diagnostik und Therapie ist daher essentiell. Nicht jeder Patient stellt sich primär in einer Einrichtung vor, in der alle diagnostischen und therapeutischen Möglichkeiten für die optimale Untersuchung und Therapie von Patienten mit akuten Aortensyndromen bestehen. Es ist daher von ausschlaggebender Bedeutung, daß derjenige Arzt, der den Patienten zuerst sieht überhaupt daran denkt, daß ein akutes Aortensyndrom vorliegen könnte und daß bereits zu diesem Zeitpunkt eine klinische Risikoanalyse durchgeführt und eine aggressive Therapie (Schmerzbehandlung, Einstellung von Blutdruck und Herzfrequenz, klinische Stabilisierung erfolgt. Vor allem bei der Risikoanalyse spielt der Laborparameter der d-Dimere eine bedeutende Rolle.
Auf der Basis dieser frühen Einschätzung muß dann unverzüglich, d.h. so schnell wie irgendwie möglich das weitere adäquate Vorgehen veranlaßt werden. Hierzu kann es auch gehören, solche Patienten umgehend in ein geeignetes Zentrum zu verlegen.